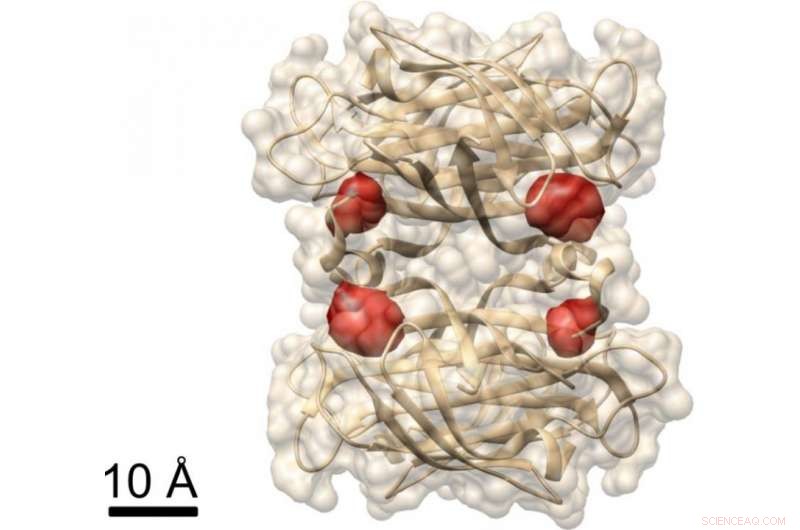
Vista de una proteína:los investigadores de Max Planck han utilizado el método COLD para visualizar los cuatro sitios de unión de la biotina (marcados por moléculas de colorante rojo) en la proteína estreptavidina. cuya estructura ya se conoce. Crédito:MPI para la ciencia de la luz
La microscopía óptica continúa revelando el mundo microscópico con una resolución cada vez mayor. Usando un nuevo método acuñado FRÍO, Los científicos del Instituto Max Planck para la Ciencia de la Luz en Erlangen ahora han visualizado estructuras de proteínas con una resolución de alrededor de 5 Å. COLD logra esta resolución sin precedentes operando a una temperatura de menos 270 grados Celsius. A temperaturas tan bajas, las señales de las proteínas fluorescentes se pueden localizar con mayor precisión. De este modo, el método abre la posibilidad de que las bajas temperaturas, las señales de las proteínas fluorescentes se pueden localizar con mayor precisión. El método abre así la posibilidad de observar cambios estructurales de proteínas asociados con enfermedades específicas.
Hasta finales del siglo XX, Los microscopios ópticos estaban sujetos a una restricción importante:su resolución estaba limitada por la naturaleza ondulatoria de la luz. Ya en 1873, el físico Ernst Abbe formuló una ley que, en términos simplificados, afirma que un microscopio óptico no puede resolver estructuras que midan menos de la mitad de la longitud de onda de la luz visible, alrededor de 200 nanómetros. "Esto corresponde a una cadena de varios miles de átomos, "explica Vahid Sandoghdar, Director del Instituto Max Planck para la Ciencia de la Luz.
Este límite se consideró insuperable, hasta que los investigadores desarrollaron métodos de microscopía de fluorescencia de superresolución, como STED y PALM / STORM, en las últimas dos décadas. Estas técnicas mejoraron la resolución óptica a alrededor de solo 20 a 30 nanómetros. En 2014, los científicos involucrados en esos inventos, incluyendo a Stefan Hell en el Instituto Max Planck de Química Biofísica en Göttingen, fueron galardonados con el Premio Nobel de Química. Recientemente, un equipo encabezado por Hell aumentó el límite de resolución otras veinte veces con la ayuda de una técnica de microscopía recientemente desarrollada conocida como MINFLUX. La resolución de este método fue suficiente para distinguir moléculas vecinas que están separadas por unos pocos nanómetros.
COLD permite vislumbrar moléculas de proteínas individuales
Vahid Sandoghdar y sus colegas han estado trabajando en métodos alternativos para aumentar el rendimiento de la microscopía de fluorescencia de alta resolución durante varios años, con un éxito considerable. como informa el físico de Erlangen:"Nuestro nuevo enfoque nos permite mostrar estructuras que están separadas por una distancia de menos de cinco angstroms, es decir, medio nanómetro. Por lo tanto, podemos analizar las moléculas de proteínas ". Sandoghdar y sus colegas presentaron el concepto básico por primera vez en 2013, que han denominado COLD para la localización óptica criogénica en tres dimensiones. El nombre COLD lo dice todo:"La clave de COLD es la baja temperatura a la que se realizan las mediciones, alrededor de menos 270 grados Celsius, "dice el físico.
El principio básico de las imágenes de fluorescencia es el mismo para todos los microscopios:la muestra se marca primero químicamente con moléculas fluorescentes llamadas fluoróforos. Esto hace que ciertas áreas o componentes de la muestra, p.ej. células, visible. Sin embargo, Las técnicas convencionales están limitadas por el límite de Abbe. Siempre que varios fluoróforos estrechamente espaciados emitan luz simultáneamente, sus señales se superponen y ya no se pueden reconocer como puntos separados. Los métodos de superresolución, por el contrario, son capaces de activar y desactivar las moléculas de tinción fluorescente. Esto permite determinar la posición de cada uno con un grado de precisión relativamente alto. Sin embargo, la precisión sufre de ruido estadístico:cuanto más brevemente los fluoróforos emiten luz, cuanto mayor es la imprecisión. Y por lo general se encienden solo por un tiempo muy corto, porque los procesos químicos inducidos por la luz blanquean la molécula.
Las moléculas se pueden localizar con mayor precisión a bajas temperaturas.
Aquí es donde entra en juego el COLD. Las temperaturas extremadamente bajas ralentizan enormemente el fotoblanqueo de modo que cada fluoróforo se ilumina durante un tiempo significativamente más largo. "Esto reduce el ruido en las imágenes y mejora la precisión de la localización, "afirma Siegfried Weisenburger, quien realizó los experimentos como parte de su investigación doctoral en el Departamento de Sandoghdar.
En colaboración con Christian Griesinger y su Departamento en el Instituto Max Planck de Química Biofísica en Gotinga, los científicos de Erlangen pudieron usar su técnica para resolver dos fluoróforos en una proteína que estaban separados por un nanómetro. A esta escala, incluso las más leves vibraciones y movimientos de la muestra arruinarán el experimento. "Para medir distancias a escala atómica, tuvimos que desarrollar un especial, microscopio criogénico extremadamente estable, Sandoghdar explica:"Las muestras se preparan distribuyendo las proteínas en una fina película de polímero sobre un portaobjetos de vidrio".
¿Cómo se organizan las proteínas en una membrana?
En otro experimento, Los investigadores demostraron que COLD se puede utilizar para determinar la estructura espacial de las proteínas:etiquetaron una proteína llamada estreptavidina en cuatro sitios específicos con fluoróforos y registraron varios cientos de imágenes. Luego reconstruyeron la estructura de la proteína con la ayuda de algoritmos de tomografía. Por último, lograron una resolución tridimensional de aproximadamente medio nanómetro al localizar las cuatro moléculas de tinte. "Esta resolución permite estudios de estructuras al límite de otros métodos en biología estructural". Esto se aplica especialmente al campo de investigación de Christian Griesinger, Espectroscopia de RMN, que solo puede resolver distancias por debajo de cinco angstroms. "COLD cierra la brecha entre la microscopía de fluorescencia y la biología estructural, "dice el director de Max Planck en Gotinga.
Los resultados son muy relevantes para varios científicos. "En las celdas, las proteínas cambian su estructura para realizar o alterar sus funciones. Es más, Los cambios estructurales específicos a menudo se asocian con enfermedades específicas, "dice Sandoghdar. Además, FRÍO puede determinar la orientación de las proteínas. "La orientación es particularmente interesante cuando se mira con proteínas en una membrana. Ese es el objeto de nuestros experimentos actuales, "explica Daniel Böning, miembro del equipo de investigación de Erlangen.
Sandoghdar espera que la resolución de COLD se pueda mejorar aún más en un factor de diez. La técnica entonces operaría a nivel atómico. Sin embargo, en ese caso, chocaría con el límite intrínseco de la microscopía de fluorescencia resultante del tamaño de las moléculas marcadoras utilizadas. "COLD es ideal para visualizar proteínas o agregados más pequeños de biomoléculas. Por otro lado, por las inhóspitas temperaturas, la técnica no se puede utilizar para investigar procesos dentro de células vivas, "Resume Sandoghdar." Por el momento, ningún método de microscopía es capaz de observarlo todo. Por lo tanto, las diversas estrategias deben seguir utilizándose, como antes y en el futuro previsible, de manera complementaria ".