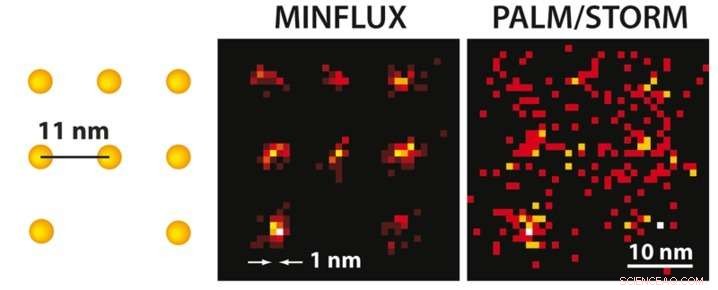
Con microscopía MINFLUX se puede, por primera vez, ópticamente separan moléculas que están a solo unos pocos nanómetros de distancia entre sí. A la izquierda, se presenta un esquema de las moléculas fluorescentes. Mientras que la microscopía PALM / STORM de ultra alta resolución con el mismo brillo molecular (derecha) ofrece una imagen difusa de las moléculas (aquí en una simulación en condiciones técnicas ideales), la posición de las moléculas individuales se puede discernir fácilmente con el MINFLUX (medio) prácticamente realizado. Crédito:MPI f. Química biofísica / K. Gwosch
Es el santo grial de la microscopía óptica:mejorar el poder de resolución de este método de manera que se puedan discernir individualmente moléculas muy cercanas entre sí. Los científicos que rodean al premio Nobel Stefan Hell en el Instituto Max Planck de Química Biofísica en Gotinga han logrado ahora lo que durante mucho tiempo se consideró imposible:han desarrollado un nuevo microscopio de fluorescencia, llamado MINFLUX, permitiendo, por primera vez, para separar ópticamente moléculas, que están separados solo por nanómetros (una millonésima de milímetro). Este microscopio es más de 100 veces más nítido que el microscopía de luz convencional y supera incluso los mejores métodos de microscopía de luz de superresolución hasta la fecha. a saber, STED desarrollado por Hell y PALM / STORM descrito por el premio Nobel Eric Betzig, hasta 20 veces. Para MINFLUX, Hell utilizó las ventajas de STED y PALM / STORM en un concepto completamente nuevo. Este avance abre nuevas oportunidades para que los investigadores investiguen cómo funciona la vida a nivel molecular.
"Hemos logrado de forma rutinaria resoluciones de un nanómetro con MINFLUX, que es el diámetro de las moléculas individuales, el límite último de lo que es posible en la microscopía de fluorescencia, "explica el infierno, Director del Instituto Max Planck de Química Biofísica. “Estoy convencido de que los microscopios MINFLUX tienen el potencial de convertirse en una de las herramientas más fundamentales de la biología celular. Con este concepto será posible mapear células en detalle molecular y observar los procesos rápidos en su interior en tiempo real. Esto podría revolucionar nuestro conocimiento de los procesos moleculares que ocurren en las células vivas ".
El físico de Gotinga, quien también trabaja en el Instituto Max Planck de Investigación Médica y el Centro Alemán de Investigación del Cáncer en Heidelberg, Hace tiempo que está convencido de que la resolución de la microscopía de fluorescencia se puede aumentar hasta la dimensión de moléculas individuales, con el uso clásico de luz enfocada y lentes convencionales.
De hecho, el físico Ernst Abbe había formulado en 1873 que la resolución de los microscopios ópticos se limita a la mitad de la longitud de onda de la luz, que es de unos 200 nanómetros. Más de 100 años después, este límite de Abbe sigue siendo válido. Sin embargo, Hell fue el primero en demostrar que este límite se puede superar con microscopía STED, que concibió en 1994 y estableció experimentalmente cinco años después.
STED y PALM / STORM, desarrollado unos años después, en la práctica, logran una nitidez de separación de aproximadamente 20 a 30 nanómetros, aproximadamente diez veces mejor que el límite de Abbe. Para el desarrollo de estas técnicas de microscopía óptica de ultra alta resolución, Hell y Betzig, junto con William E. Moerner, recibieron el Premio Nobel de Química 2014.
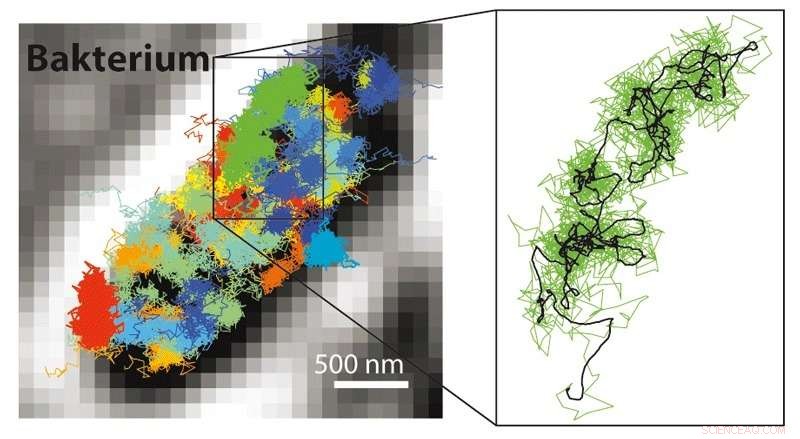
Con MINFLUX es posible seguir muchos movimientos mucho más rápidos que con microscopía STED o PALM / STORM. Por tanto, es posible hacer visibles los movimientos de moléculas marcadas con fluorescencia en una célula viva. Izquierda:patrón de movimiento de los ribosomas 30S (partes de fábricas de proteínas, coloreado) en una bacteria E. coli (negro-blanco). Derecha:patrón de movimiento de un solo ribosoma 30S (verde) que se muestra ampliado. Crédito:MPI f. Química biofísica / Y. Eilers
Ventajas de STED y PALM / STORM combinadas
Tanto STED como PALM / STORM separan las moléculas fluorescentes vecinas encendiéndolas y apagándolas una tras otra para que emitan fluorescencia secuencialmente. Sin embargo, los métodos difieren en un punto esencial:la microscopía STED utiliza un rayo láser en forma de rosquilla para apagar la fluorescencia molecular en un lugar fijo de la muestra, es decir, en todas partes de la región focal excepto en el centro de la rosquilla. La ventaja es que el haz de rosquilla define exactamente en qué punto del espacio se encuentra la correspondiente molécula brillante. La desventaja es que, en la práctica, el rayo láser no es lo suficientemente fuerte como para limitar la emisión a una sola molécula en el centro de la rosquilla. En el caso de PALM / STORM, por otra parte, el encendido y apagado se realiza en ubicaciones aleatorias y en el nivel de una sola molécula. La ventaja aquí es que uno ya está trabajando en el nivel de una sola molécula, pero una desventaja es que no se conocen las posiciones exactas de las moléculas en el espacio. Las posiciones deben determinarse recolectando tantos fotones de fluorescencia como sea posible en una cámara; mas de 50, Se necesitan 000 fotones detectados para alcanzar una resolución de menos de 10 nanómetros. En la práctica, por lo tanto, no se puede lograr rutinariamente una resolución molecular (un nanómetro).
Hell tuvo la idea de combinar de manera única las fortalezas de ambos métodos en un nuevo concepto. "Esta tarea fue todo menos trivial. Pero mis compañeros de trabajo Francisco Balzarotti, Yvan Eilers, y Klaus Gwosch han hecho un trabajo maravilloso al implementar esta idea de manera experimental conmigo ". Su nueva técnica, llamado MINFLUX (Flujos de emisión mínima), ahora es presentado por Hell junto con los tres científicos jóvenes como primeros autores en Science.
MINFLUX, como PALM / STORM, activa y desactiva moléculas individuales de forma aleatoria. Sin embargo, al mismo tiempo, sus posiciones exactas se determinan con un rayo láser en forma de rosquilla como en STED. A diferencia de STED, el rayo de rosquilla aquí excita la fluorescencia. Si la molécula está en el anillo, brillará si está exactamente en el centro oscuro, no brillará pero uno ha encontrado su posición exacta. Balzarotti desarrolló un algoritmo inteligente para que esta posición pudiera ubicarse muy rápido y con alta precisión. "Con este algoritmo fue posible aprovechar el potencial del haz de excitación en forma de rosca, "explica el joven científico. Gwosch, quién obtuvo las imágenes de resolución molecular, agrega:"Fue una sensación increíble ya que nosotros, por primera vez, fueron capaces de distinguir detalles con MINFLUX en la escala de unos pocos nanómetros ".
Resolución 100 veces mejor
Además de la resolución molecular, la combinación de STED y PALM / STORM ofrece una gran ventaja adicional:"MINFLUX es mucho más rápido en comparación. Como funciona con un rayo láser de rosquilla, Requiere una señal de luz mucho más baja, es decir, menos fotones de fluorescencia, por molécula en comparación con PALM / STORM para lograr la máxima resolución, "Estados del infierno. Ya con STED se podían grabar videos en tiempo real desde el interior de las células vivas. Pero ahora era posible rastrear el movimiento de las moléculas en una célula con una resolución temporal 100 veces mejor, como enfatiza Eilers. Logró filmar el movimiento de moléculas en una bacteria E. coli viva con MINFLUX por primera vez, con una resolución espacio-temporal sin precedentes. "En cuanto a la velocidad, no hemos aprovechado al máximo las posibilidades con MINFLUX, ", Dice Eilers. Los investigadores están convencidos de que incluso los cambios que ocurren extremadamente rápido en las células vivas se pueden investigar en el futuro, como por ejemplo el movimiento de nanomáquinas celulares o el plegamiento de proteínas.