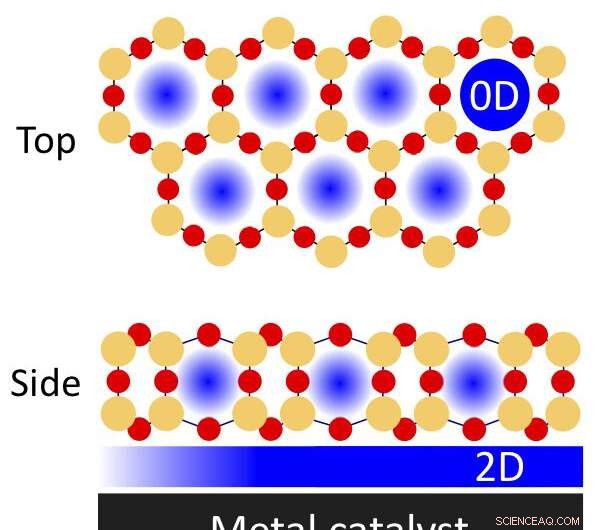
Una ilustración de espacios físicamente confinados en una película de sílice bicapa porosa sobre un catalizador metálico que se puede utilizar para reacciones químicas. Los átomos de silicio están indicados por círculos naranjas; átomos de oxígeno por los círculos rojos. El nanoconfinamiento puede ocurrir en los poros (dimensión cero, o 0-D) y la región confinada de interfaz entre la película y el metal (bidimensional, 2-D). Crédito:Laboratorio Nacional Brookhaven
Los espacios físicamente confinados pueden hacer que las reacciones químicas sean más eficientes, según estudios recientes dirigidos por científicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. (DOE). Descubrieron que cubrir parcialmente las superficies metálicas que actúan como catalizadores, o materiales que aceleran las reacciones, con películas delgadas de sílice puede afectar las energías y velocidades de estas reacciones. La sílice delgada forma una matriz bidimensional (2-D) de "jaulas" con forma de prisma hexagonal que contienen átomos de silicio y oxígeno.
"Estas estructuras de sílice porosa tienen el grosor de solo tres átomos, "explicó Samuel Tenney, químico en el Grupo de Catálisis y Ciencia de Interfaces del Centro de Nanomateriales Funcionales (CFN) de Brookhaven Lab. "Si los poros fueran demasiado altos, ciertas ramas de moléculas no podrían alcanzar la interfaz. Hay una geometría particular en la que las moléculas pueden entrar y unirse, algo así como la forma en que una enzima y un sustrato se unen. Las moléculas con el tamaño apropiado pueden deslizarse a través de los poros e interactuar con la superficie del metal catalíticamente activo ".
"La sílice bicapa en realidad no está anclada a la superficie del metal, "agregó Calley Eads, un investigador asociado en el mismo grupo. "Hay fuerzas débiles en el medio. Esta interacción débil permite que las moléculas no solo penetren en los poros, sino que también exploren la superficie catalítica y encuentren los sitios más reactivos y la geometría de reacción optimizada moviéndose horizontalmente en el espacio confinado entre la bicapa y el metal. Si estuviera anclado, la bicapa solo tendría un sitio de poro para que cada molécula interactúe con el metal ".
Los científicos están descubriendo que los espacios confinados modifican diferentes tipos de reacciones, y están trabajando para entender por qué.
Tenney y Eads son coautores de la investigación publicada recientemente en Angewandte Chemie , demostrando este efecto de confinamiento para una reacción de importancia industrial:la oxidación del monóxido de carbono. El monóxido de carbono es un componente tóxico del escape del motor de los vehículos y, por lo tanto, debe eliminarse. Con la ayuda de un catalizador de metal precioso apropiado como el paladio, platino, o rodio, Los convertidores catalíticos de los vehículos combinan el monóxido de carbono con el oxígeno para formar dióxido de carbono.
Tenney, Eads, y sus colegas del CFN y el National Synchrotron Light Source II de Brookhaven (NSLS-II) demostraron que cubrir el paladio con sílice aumenta la cantidad de dióxido de carbono producido en un 20 por ciento, en comparación con la reacción sobre paladio desnudo.
Para lograr esta mejora del rendimiento, Los científicos primero tuvieron que obtener una estructura de dos capas completa a través de la superficie del paladio. Para hacerlo calentaron una cantidad calibrada de silicio a temperaturas de sublimación en un ambiente de oxígeno a alta presión. En sublimación, un sólido se transforma directamente en gas. A medida que se creaba la fina película de sílice, probaron su estructura con difracción de electrones de baja energía. En esta técnica, los electrones que chocan contra un material se difractan en un patrón característico de la estructura cristalina del material.
"Continuamos calentando hasta que obtenemos estructuras altamente cristalinas con tamaños de poros bien definidos que podemos usar para explorar la química que nos interesa". "dijo Eads.
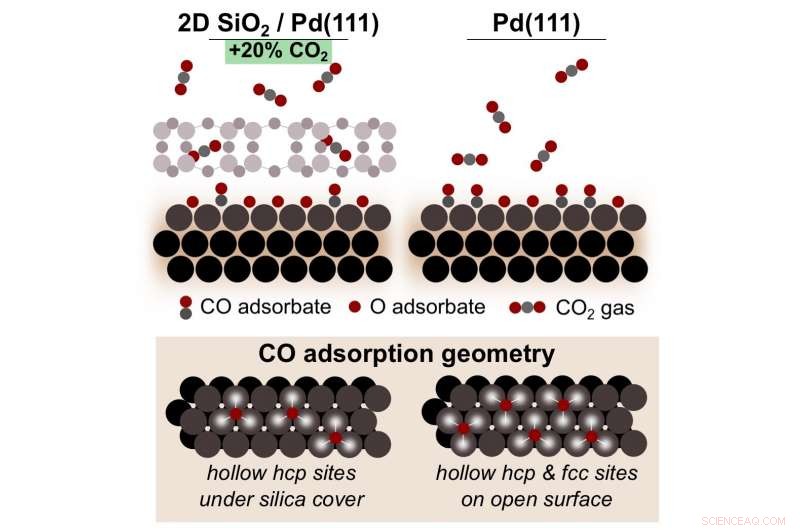
Un esquema que muestra cómo la oxidación de monóxido de carbono (CO) en paladio (Pd) bajo una sílice microporosa 2-D (SiO, 2) la cubierta produce un 20 por ciento más de dióxido de carbono (CO 2 ), en comparación con la reacción en Pd desnudo. Este microambiente interfacial fomenta una mayor cobertura de óxidos de superficie reactivos de Pd que son clave para convertir CO en CO 2 . Crédito:Laboratorio Nacional Brookhaven
Aquí, el equipo rastreó reactivos y productos y el entorno de enlace químico en el espacio confinado 2-D durante la oxidación del monóxido de carbono, aumentando gradualmente la temperatura. Para rastrear esta información, simultáneamente llevaron a cabo espectroscopía de fotoelectrones de rayos X a presión ambiental (AP-XPS) y espectrometría de masas (MS) en el NSLS-II y espectroscopía de reflexión-absorción infrarroja (IRAAS) en el CFN.
"AP-XPS nos dice qué elementos están presentes, ya sea en la superficie o en fase gaseosa, ", dijo Tenney." También puede darnos información sobre el estado de oxidación química o la geometría de unión de los átomos, ya sea que un carbono esté unido a uno o dos átomos de oxígeno, por ejemplo. La EM nos ayuda a identificar las moléculas en fase gaseosa que vemos evolucionar en nuestro sistema en función de su peso y carga. IRRAS es una huella dactilar del tipo de enlaces químicos presentes entre los átomos y muestra la conformación y orientación de las moléculas de monóxido de carbono adsorbidas en la superficie ".
Según el coautor Dario Stacchiola, líder del Grupo de Catálisis y Ciencia de Interfaces CFN, Una de las capacidades únicas del equipo es la capacidad de utilizar herramientas complementarias de caracterización de superficies para analizar la misma muestra sin exponerla al aire. que podría causar contaminación.
"La reproducibilidad es a menudo un problema en la catálisis, ", dijo Stacchiola." Pero tenemos una configuración que nos permite preparar una muestra en condiciones de ultra alto vacío muy prístinas y exponer la misma muestra a presiones de gases industrialmente relevantes ".
Los resultados experimentales mostraron un fuerte aumento en la cantidad de dióxido de carbono por encima de una temperatura crítica. Por debajo de esta temperatura, el monóxido de carbono "envenena" la superficie, impidiendo que la reacción continúe. Sin embargo, una vez que se alcanza el umbral de temperatura, el oxígeno molecular comienza a dividirse en dos átomos de oxígeno individuales en la superficie del paladio y forma un óxido superficial. Estos átomos de oxígeno se combinan con el monóxido de carbono para formar dióxido de carbono, evitando así el envenenamiento.
"El espacio confinado está cambiando la energía y la cinética de la reacción para producir más dióxido de carbono, "dijo Eads, quien dirigió la implementación reciente de este nuevo enfoque de análisis de superficie multimodal para estudiar películas nanoporosas en condiciones operativas.
"Al aplicar películas delgadas sobre un catalizador tradicional que se ha estudiado durante décadas, hemos introducido un "botón" para adaptar la química a determinadas reacciones, ", dijo Tenney." Incluso una mejora del uno por ciento en la eficiencia del catalizador puede traducirse en ahorros económicos en la producción a gran escala ".
"Descubrimos que una capa muy fina de un óxido económico puede impulsar significativamente la actividad catalítica sin aumentar la cantidad del costoso metal precioso que se utiliza como catalizador, "añadió Stacchiola.

Crecimiento y caracterización de una película de sílice bicapa utilizando un microscopio electrónico de baja energía (LEEM) con imágenes de campo completo. Este tipo de microscopía permite a los científicos seguir los cambios en la estructura de la película a medida que crece en tiempo real. La figura (a) muestra una superficie de paladio limpia fotografiada con LEEM (esfera grande) y su patrón de difracción de electrones acompañante (esfera pequeña). La figura (b) muestra los patrones de imágenes y difracción para sílice bicapa (SiO2) cultivada en paladio. Crédito:Laboratorio Nacional Brookhaven
Previamente, El equipo estudió la dinámica de la reacción del alcohol furfurílico en una superficie de paladio cubierta por sílice bicapa. El alcohol furfurílico es una molécula derivada de la biomasa que se puede convertir en biocombustible. En comparación con la oxidación del monóxido de carbono, que solo hace un solo producto, las reacciones con biomoléculas más grandes y complejas, como el alcohol furfurílico, pueden generar muchos subproductos no deseados. Sus datos preliminares mostraron el potencial para ajustar la selectividad de la reacción del alcohol furfurílico con la cubierta de sílice bicapa.
"Cambiar la actividad catalítica es genial, eso es lo que vemos en el estudio de oxidación del monóxido de carbono, "dijo Stacchiola." El siguiente paso es demostrar que podemos usar las cubiertas de óxido para ajustar la selectividad para reacciones particulares. Creemos que nuestro enfoque se puede aplicar ampliamente en la catálisis ".
El año pasado, otros miembros del grupo de Stacchiola, junto con colegas del Grupo de Teoría y Computación de CFN, Universidad de Stony Brook (SBU), y la Universidad de Wisconsin-Milwaukee, publicaron un estudio relacionado en Catálisis ACS , una revista de la American Chemical Society (ACS). Combinando experimento y teoría, descubrieron por qué la reacción de formación de agua catalizada por el rutenio metálico se acelera en confinamiento con sílice bicapa.
"La química en espacios confinados es un área de investigación bastante nueva, "dijo el coautor correspondiente Deyu Lu, físico del Grupo de Teoría y Computación CFN. "En la ultima década, Ha habido muchos informes de que el confinamiento afecta la química, pero ha faltado en gran medida una comprensión mecanicista a escala atómica ".
En el Catálisis ACS estudio, el equipo de CFN demostró que el confinamiento puede cambiar la vía por la cual ocurre la reacción. La formación de agua puede proceder por dos posibles vías de reacción:hidrogenación directa y desproporción. La principal diferencia es cómo se forma el primer grupo hidroxilo, el oxígeno unido al hidrógeno. Según los cálculos de Lu y el primer autor y estudiante de SBU, Mengen Wang, este paso de reacción cuesta más energía.
En el camino directo, Las moléculas de hidrógeno se disocian en la superficie en dos átomos de hidrógeno, que se combinan con un oxígeno absorbido químicamente en la superficie. Estos grupos hidroxilo se combinan con otro átomo de hidrógeno para producir agua. Por la vía de la desproporción, el agua, que todavía puede provenir inicialmente de la vía directa, primero debe estabilizarse en la superficie. Luego, el agua se puede combinar con el oxígeno de la superficie para formar dos grupos hidroxilo en la superficie. Estos grupos hidroxilo pueden unirse con dos átomos de hidrógeno para formar dos moléculas de agua. Estas moléculas de agua pueden formar más grupos hidroxilo, formando un bucle en la ruta de la desproporción.
En experimentos AP-XPS basados en laboratorio en el CFN, el equipo descubrió que la temperatura necesaria para activar la reacción de formación de agua era mucho más baja cuando la sílice cubría el rutenio, en comparación con el metal por sí mismo.
"El hecho de que la reacción tenga lugar a temperaturas más bajas en confinamiento está parcialmente relacionado con su menor energía de activación, "explicó el co-autor correspondiente Anibal Boscoboinik, químico en el CFN Interface Science and Catalysis Group. "A partir de los datos de AP-XPS sobre oxígeno superficial, indirectamente podemos derivar la energía requerida para activar la reacción. Vemos que esta energía de activación es mucho menor cuando la sílice está encima del rutenio ".
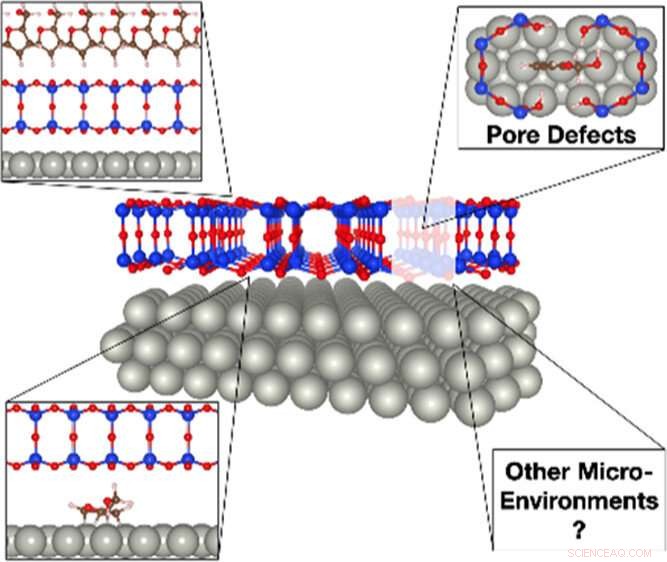
Una ilustración del impacto de la sílice bicapa en la conversión de biomasa. Las moléculas de biomasa voluminosas, como el alcohol furfurílico, solo pueden infiltrarse en la película de sílice en los sitios de defectos de los poros para interactuar con el paladio catalíticamente activo. Una vez atrapado debajo de la cubierta de sílice, El alcohol furfurílico puede descomponerse en varios derivados, en particular propano, que es difícil de producir en la superficie abierta. Crédito:Laboratorio Nacional Brookhaven
Aplicando un método computacional popular llamado teoría funcional de densidad, el equipo utilizó supercomputadoras para estudiar la energía de la reacción. Inicialmente, los experimentadores plantearon la hipótesis de que la energía de activación reducida para la etapa de limitación de la velocidad de la reacción (que forma el primer grupo hidroxilo) se debía a la presión de la sílice sobre el complejo de reacción. Sin embargo, los cálculos mostraron que la presencia de sílice no cambió esta energía de manera significativa. Bastante, cambió la vía de reacción. Sobre la superficie desnuda de rutenio, se favoreció la vía directa; en presencia de sílice, moléculas de agua estabilizadas en la superficie, activando la vía de la desproporción.
"Sin la cubierta de sílice, las moléculas de agua se desorben, y la reacción sigue la vía directa, "dijo Lu." Debajo de la cubierta de sílice, el agua necesita cruzar varias barreras de energía cinética para poder salir de la superficie. Estas barreras cinéticas atrapan las moléculas de agua en la superficie del metal y activan la vía de desproporción, permitiendo que los grupos hidroxilo se produzcan en una barrera energética mucho más baja, en comparación con el caso sin los efectos del confinamiento ".
Aunque la formación de agua no es relevante para la industria, Los científicos dicen que estudiar este modelo de reacción puede ayudarlos a comprender cómo aprovechar los efectos del confinamiento para favorecer ciertas vías de reacción para reacciones más relevantes. En otras palabras, el mismo principio fundamental se puede aplicar a otros sistemas. Por ejemplo, se podría recubrir con sílice los electrodos para evocar vías particulares en las interfaces líquido-sólido en las celdas electroquímicas. En ese caso, la reacción sería la opuesta:el agua se disociaría en oxígeno e hidrógeno, un combustible limpio.
"Comprender esta reacción nos ayuda a comprender la reacción inversa, "dijo Boscoboinik, quien publicó recientemente un resumen de los estudios iniciales sobre los efectos del confinamiento con películas delgadas porosas en 2-D. "Si nos guiamos solo por el experimento, hubiéramos atribuido la explicación incorrecta. La teoría demostró que nuestra hipótesis inicial era incorrecta y jugó un papel clave en revelar el mecanismo de reacción correcto a nivel microscópico ".
Todavía, los científicos han visto otros ejemplos en los que la sílice tiene un efecto relacionado con la presión. En 2019, encontraron que la sílice bicapa presiona el xenón de gas noble en la interfaz entre la sílice bicapa y el rutenio, induciendo una unión más fuerte entre el xenón y el rutenio.
"Diferentes efectos surgen del confinamiento, ", dijo Stacchiola." Es muy interesante, Rico, y zona mayoritariamente inexplorada. Estamos entusiasmados de seguir investigando la química en espacios reducidos en los próximos años ".