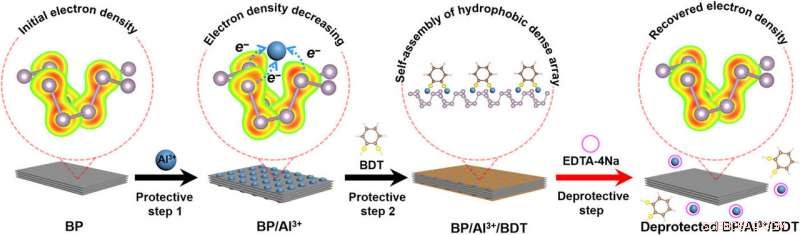
Ilustración esquemática de la regulación de la reactividad de BP mediante química protectora. Paso de protección 1:la unión de iones Al3 + con un par de electrones solitarios en la superficie de los átomos de P disminuye la densidad de electrones de superficie de BP, conduciendo a una reactividad química reducida de BP. Paso de protección 2:el autoensamblaje de la matriz densa hidrófoba en la superficie de BP aísla a BP del oxígeno / agua circundante. Etapa desprotectora:Eliminación de iones Al3 + y matriz densa hidrófoba en la superficie de BP mediante un agente quelante. El tratamiento recupera la densidad electrónica de BP, restaurar la reactividad original del BP desprotegido. BDT, 1, 2-bencenoditiol; EDTA-4Na, EDTA-tetrasodio. Crédito:Science Advances, doi:10.1126 / sciadv.abb4359.
Los químicos pueden regular racionalmente la reactividad de moléculas y grupos funcionales en procesos de química orgánica sintética tanto industriales como de laboratorio. El concepto se puede aplicar a los nanomateriales inorgánicos, incluidas las nanoláminas bidimensionales (2-D) de fósforo negro (BP). Por ejemplo, los científicos pueden "apagar" la alta reactividad del fósforo negro de pocas capas o monocapa, cuando el compuesto no está en uso, para reanudar su actividad previa solicitud. En un nuevo informe ahora publicado en Avances de la ciencia , Xiao Liu y un equipo de científicos en física, biomateriales, La ingeniería química y la química biológica en China desarrollaron un método basado en la química protectora para regular la reactividad del fósforo negro.
Para iniciar el paso de protección, unieron cationes de aluminio (Al 3+ ) con pares de electrones solitarios del fósforo negro (BP) y disminuyó la densidad de electrones en la superficie del fósforo negro. Completaron el proceso con una capa resistente al oxígeno / agua a través del autoensamblaje de hidrofóbicos (que odian el agua) 1, 2-bencenoditiol (BDT) sobre fósforo negro / aluminio (BP / Al 3+ ) conjugado. El paso protector produjo un compuesto estable con baja reactividad. Mediante el uso de un proceso de tratamiento quelante, Liu y col. Posteriormente logró la desprotección de la BP / Al 3+ / Complejo BDT para eliminar los cationes de aluminio y BDT de la superficie del fósforo negro. De este modo, recuperaron la densidad electrónica del fósforo negro utilizando el proceso de desprotección para restaurar la reactividad al compuesto.
Afinando las propiedades de los nanomateriales
Liu y col. desarrolló racionalmente un método basado en la química protectora para controlar la reactividad del fósforo negro durante este trabajo. En nanociencia, los investigadores pueden ajustar con precisión las propiedades de los nanomateriales para obtener las características deseadas. La regulación de la reactividad de los nanomateriales es fundamental para las aplicaciones programables de varios pasos. Algunos nanomateriales pueden protegerse para reducir su reactividad en condiciones específicas y restaurar la actividad después de una desprotección exitosa. Por tanto, los investigadores han propuesto una serie de estrategias selectivas y eficientes para regular la reactividad de los grupos funcionales en la química orgánica.
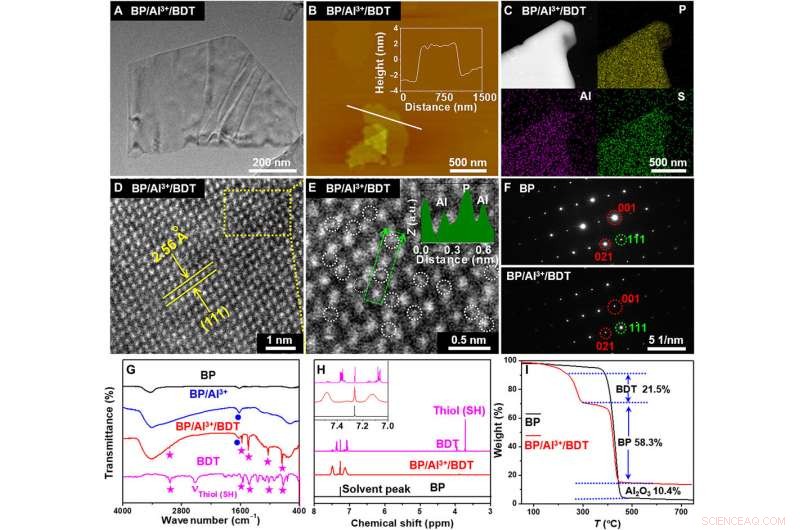
Caracterización de BP / Al3 + / BDT. (A) Imagen TEM. (B) Imagen AFM (perfil de altura a lo largo de la línea blanca). (C) Imágenes de mapeo elemental de espectroscopía de rayos X de dispersión de energía STEM (EDX). (D) Imagen de campo oscuro anular de ángulo alto (HAADF). (E) Imagen HAADF ampliada tomada del área seleccionada en (D). a.u .:unidades arbitrarias. (F) Patrón de difracción de electrones de área seleccionada (SAED) de BP y BP / Al3 + / BDT. (G) espectros FTIR de BP, BP / Al3 +, BP / Al3 + / BDT, y BDT. (H) espectros de RMN 1H de BP, BP / Al3 + / BDT, y BDT. (I) Curvas termogravimétricas de BP y BP / Al3 + / BDT. ppm, partes por millón. Crédito:Science Advances, doi:10.1126 / sciadv.abb4359.
Sin embargo, Los procesos protectores-desprotectores orgánicos bien establecidos existentes no se pueden aplicar a los nanomateriales inorgánicos debido a la falta de grupos funcionales similares. Como resultado, Queda por desarrollar un enfoque eficaz y sencillo para controlar la reactividad de los materiales inorgánicos. Para lograr esto, el equipo comenzó a unir fósforo negro con cationes de aluminio (Al 3+ ) para disminuir la densidad de electrones de la superficie y disminuir efectivamente su reactividad. El proceso de protección produjo una disposición de lo hidrofóbico (que odia el agua) 1, Molécula de 2-benezenditiol (BDT) en presencia de fósforo negro y Al 3+ cationes para ofrecer un complejo ultraestable (BP / Al 3+ / BDT). El compuesto fue estable en condiciones ambientales durante hasta dos meses sin alteraciones. El equipo puede desproteger el complejo inestable mediante un tratamiento quelante.
Síntesis y caracterización del BP / Al 3+ / Compuesto BDT
Liu y col. sintetizó y caracterizó (probó) el fósforo negro (BP) a granel siguiendo un método desarrollado previamente. El equipo obtuvo por primera vez nanohojas de BP mediante la sonicación de la forma en polvo de la molécula, luego usando microscopía electrónica de barrido y microscopía electrónica de transmisión (TEM), observaron el tamaño de BP. La TEM de alta resolución también proporcionó información sobre la estructura de la nanoplaca y la microscopía de fuerza atómica reveló el grosor de BP con cuatro a seis capas individuales de capas de fosforeno. Usando difracción de rayos X y espectros Raman, el equipo determinó que las características del cristal de BP son similares a su forma a granel. En el paso protector de la unión catiónica a la superficie de BP, Liu y col. BP mezclado con cloruro de aluminio (AlCl 3 ) en una solución de etanol. Luego caracterizaron el apego exitoso de Al 3+ cationes a la superficie de BP para fortalecer la protección de BP mediante el empleo de espectroscopía de fotoelectrones de rayos X. El equipo observó la nanomorfología del compuesto y estudió la conformación de la superficie utilizando microscopía electrónica de transmisión de barrido (STEM) y verificó aún más su estructura con espectroscopía infrarroja por transformada de Fourier (FTIR) y resonancia magnética nuclear de protones ( 1 HNMR).
Caracterización de BP y BP / Al3 + / BDT degradados en condiciones ambientales. Imágenes de microscopio de polarización de (A) BP a granel (0, 1, y 7 días) y (B) a granel BP / Al3 + / BDT (0, 30, y 60 días). Recuadros:imágenes TEM correspondientes. Barras de escala, 200 nm. (C y D) Espectros HR-XPS de picos P 2p para BP y BP / Al3 + / BDT con exposición ambiental durante varias duraciones. (E y F) Espectros UV-vis de BP y BP / Al3 + / BDT dispersos en agua durante varias duraciones. Recuadros:variación de las relaciones de absorción UV-vis a 470 nm (A / A0) de BP (A0:valor original). Crédito:Science Advances, doi:10.1126 / sciadv.abb4359 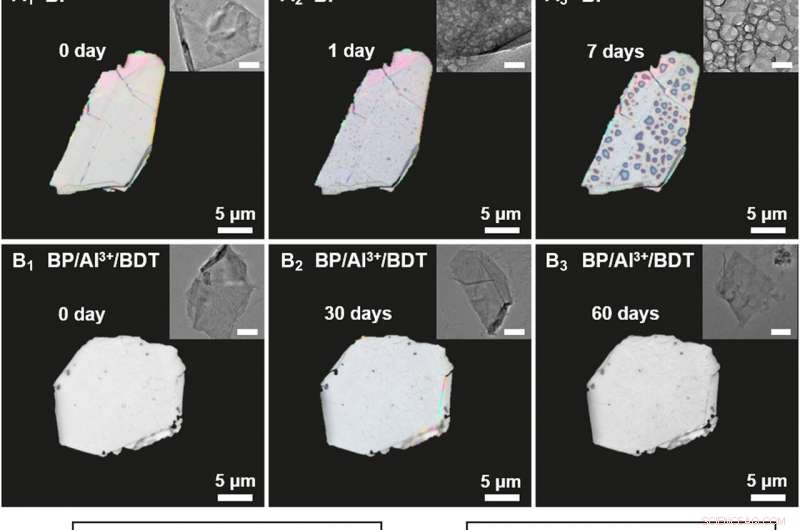
Liu y col. investigó la reactividad del BP / Al 3+ / Complejo BDT mediante el empleo de una variedad de técnicas ópticas en la ciencia de los materiales para comprender su estructura. Las imágenes correspondientes mostraron la evolución de la estructura cristalina y la estabilidad a largo plazo en condiciones ambientales. La estabilidad del BP / Al 3+ / El complejo BDT fue superior al fósforo negro solo y los resultados destacaron la practicidad de incrustar fósforo negro en el compuesto. El equipo atribuyó la reactividad reducida de la estructura compleja a dos factores; primero, el catión de aluminio que se une a la superficie del fósforo negro produjo una menor reactividad química. Segundo, la matriz densa hidrofóbica autoensamblada en la superficie del fósforo negro aisló la molécula del oxígeno y el agua para evitar una mayor degradación, mejorando la estabilidad del compuesto.
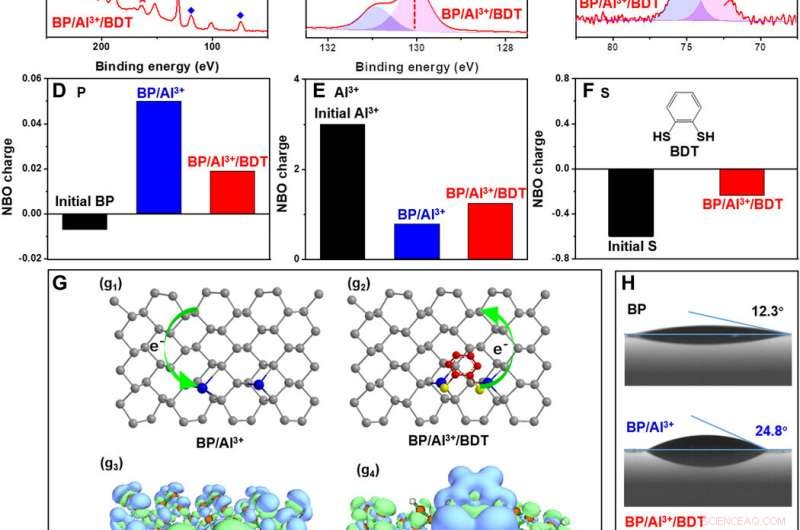
Mecanismo de disminución de la reactividad en la PA protegida. (A) Espectros XPS completos de BP, BP / Al3 +, y BP / Al3 + / BDT. (B y C) Espectros HR-XPS de P 2p y Al 2p. (D a F) Carga NBO calculada del átomo de P, Iones Al3 +, y átomo de S. Modelo de estructura de (G1) BP / Al3 + y (G2) BP / Al3 + / BDT. Mapeo computacional de la diferencia de densidad de electrones en (G3) BP / Al3 + y (G4) BP / Al3 + / BDT. Las regiones verdes indican una mayor densidad de electrones, y las regiones azules indican una disminución de la densidad de electrones. Los contornos se muestran en el 0.0001 a.u. nivel. (H) Ángulos de contacto con el agua de BP, BP / Al3 +, y BP / Al3 + / BDT. Crédito:Science Advances, doi:10.1126 / sciadv.abb4359.
Desprotegiendo el BP / Al 3+ / Compuesto BDT
El equipo de investigación desprotegió el complejo ultraestable eliminando el catión de aluminio de la superficie del compuesto. Lograron este paso con un quelante de iones metálicos convencional:edetato de sodio (EDTA-4Na). Durante el proceso, Liu y col. también eliminó las moléculas de BDT hidrófobas junto con los cationes de aluminio, para obtener la superficie hidrófila (amante del agua) resultante con potencial zeta negativo, similar en forma a la molécula de fósforo negro original. El proceso de regulación protectora-desprotectora permitió a los científicos controlar de forma reversible la reactividad del fósforo negro. Los resultados sugieren la capacidad de regular eficazmente la reactividad de la molécula en la práctica.
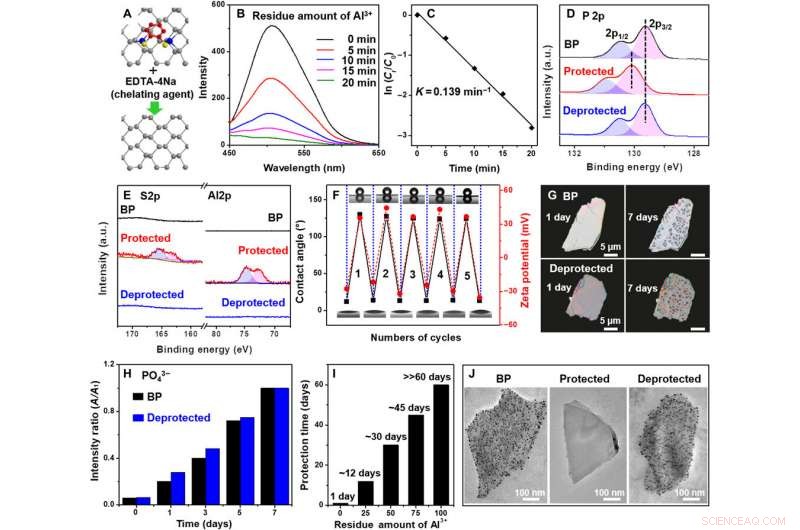
Desprotección de BP / Al3 + / BDT. (A) Ilustración esquemática de la eliminación de iones Al3 + y BDT por EDTA-4Na. (B) Espectros de emisión de fotoluminiscencia (PL) del residuo Al3 + en BP / Al3 + / BDT después del tratamiento con EDTA-4Na. (C) Gráfico de ln (Ct / C0) en función del tiempo de tratamiento con EDTA-4Na. (D y E) espectros HR-XPS de P 2p, Al 2p, y S 2p para BP, BP / Al3 + / BDT, y BP / Al3 + / BDT desprotegido. (F) Gráficos de los ángulos de contacto del agua y los potenciales zeta de BP medidos en cada ciclo de protección-desprotección. (G) Imágenes de microscopio de polarización de BP a granel (0 y 7 días) y BP / Al3 + / BDT desprotegido a granel (0 y 7 días). (H) Variación de la concentración de PO43− en soluciones de BP y BP / Al3 + / BDT desprotegidas con diferentes duraciones de exposición ambiental. (I) Estabilidad de BP / Al3 + / BDT desprotegido con una cantidad residual variable de ion Al3 + en la superficie de BP. (J) Imágenes TEM de BP, BP / Al3 + / BDT, y BP / Al3 + / BDT desprotegido después del tratamiento con HAuCl4 (solución acuosa). Crédito:Science Advances, doi:10.1126 / sciadv.abb4359.
panorama
De este modo, Xiao Liu, y sus colegas desarrollaron un nuevo enfoque basado en la química protectora para regular racionalmente la reactividad del fósforo negro (BP). Durante el paso protector, unieron cationes de aluminio (Al 3+ ) al par solitario de electrones en BP para disminuir su densidad de electrones en la superficie. Este paso protector mejoró la funcionalización del hidrofóbico (que odia el agua) 1, 2-benezenditiol (BDT), en el BP / Al 3+ conjugar la superficie para formar una densa capa hidrófoba, que redujo en gran medida la reactividad del fósforo negro. Luego, el equipo utilizó un quelante para eliminar los cationes de aluminio del fósforo negro para revertir la molécula a su alta densidad de electrones original. Superficie hidrofílica (amante del agua). El BP desprotegido mostró una alta reactividad en su estado original. El método proporcionó un enfoque ajustable para manipular la reactividad de BP, que es difícil de lograr mediante la funcionalización convencional. Esta estrategia protectora se puede explorar para regular la reactividad de los nanomateriales para crear nanoestructuras programables futuristas para aplicaciones en la ciencia de los materiales.
© 2020 Science X Network