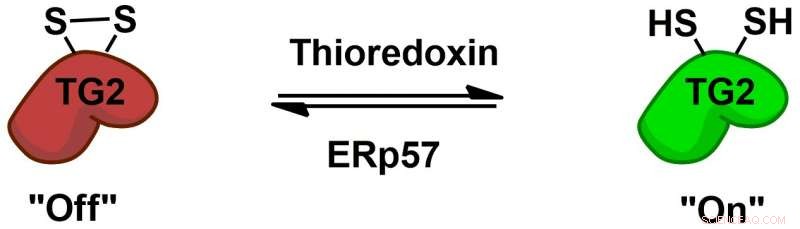
La transglutaminasa 2 (TG2) está regulada de forma reversible por los cofactores proteicos tiorredoxina y ERp57 mediante un interruptor redox disulfuro alostérico. Crédito:Chaitan Khosla, Universidad Stanford
La enfermedad celíaca es un trastorno autoinmune que, según algunas estimaciones, afecta a casi 1 de cada 100 personas. Los síntomas de la enfermedad celíaca son provocados por el gluten, una proteína que se encuentra en el trigo y plantas relacionadas, pero el gluten no actúa solo para causar los síntomas digestivos que sufren los pacientes. Bastante, el gluten induce una respuesta inmune hiperactiva cuando es modificado por la enzima transglutaminasa 2, o TG2, en el intestino delgado. Nueva investigación publicada en la edición del 23 de febrero de la Revista de química biológica identifica una enzima que apaga TG2, potencialmente allanando el camino para nuevos tratamientos para la enfermedad celíaca.
"En la actualidad, faltan terapias para tratar a las personas con enfermedad celíaca. El mejor enfoque en este momento es simplemente una estricta adherencia a una dieta libre de gluten de por vida, "dijo Michael Yi, un estudiante graduado de ingeniería química en la Universidad de Stanford que dirigió el nuevo estudio. "Quizás la razón detrás de esto es nuestra comprensión relativamente pobre de TG2".
La bioquímica de cómo TG2 interactúa con el gluten e induce una respuesta inmune ha sido bien estudiada. pero quedan misterios más básicos, por ejemplo, cómo se comporta TG2 en personas sin enfermedad celíaca. Chaitan Khosla, el profesor de Stanford y director de Química de Stanford, Engineering &Medicine for Human Health que supervisó el nuevo estudio, ha realizado varios estudios que demuestran que TG2 puede estar activo o inactivo, dependiendo de la formación o ruptura de un enlace químico específico, llamado enlace disulfuro, entre dos aminoácidos de la enzima.
"(E) a pesar de que hay mucha proteína transglutaminasa 2 en el (intestino delgado), está todo inactivo, ", Dijo Khosla." Cuando quedó claro que a pesar de que la proteína era abundante, su actividad era inexistente en un órgano sano, la pregunta se convirtió en '¿Qué activa la proteína? y luego, ¿qué apaga la proteína? '"En 2011, El equipo de Khosla identificó la enzima que activa TG2 al romper su enlace disulfuro. En el nuevo periódico, los investigadores realizaron experimentos en cultivos celulares y encontraron una enzima que vuelve a formar este enlace, inactivando TG2. Esta enzima, ERp57, es principalmente conocido por ayudar a plegar las proteínas dentro de la célula. Cuando apaga TG2, lo hace fuera de las células, planteando más preguntas sobre sus funciones en personas sanas.
"Nadie entiende realmente cómo (Erp57) sale de la celda, ", Dijo Khosla." El pensamiento general es que se exporta desde la celda en pequeñas cantidades; esta observación en particular sugiere que en realidad tiene un papel biológico fuera de la célula ".
TG2 es ahora también la primera proteína que se sabe que tiene un interruptor de encendido / apagado de enlace disulfuro reversible de este tipo. "Este es un tipo de química intermitente muy diferente a la que los químicos médicos (típicamente) usarían, "Dijo Khosla.
La comprensión de este mecanismo ha llevado al equipo a investigar si existen medicamentos aprobados por la FDA que podrían apuntar directamente al interruptor. Debido a que estudios previos han sugerido que la falta de TG2 no parece afectar negativamente la salud de los ratones, El bloqueo de TG2 es una vía prometedora para tratar a los pacientes con enfermedad celíaca sin requerir cambios de por vida en sus dietas.