
Cada subunidad proteica es de diferente color. El dominio V1 es superior, Vo fondo tallos periféricos a izquierda y derecha. El fondo muestra una bomba de agua impulsada por el viento. Crédito:IST Austria, 2019
Las células dependen de complejos de proteínas conocidos como ATP sintasas o ATPasas para sus necesidades energéticas. Las moléculas de trifosfato de adenosina (ATP) impulsan la mayoría de los procesos que sustentan la vida. El biólogo estructural Profesor Leonid Sazanov y su grupo de investigación del Instituto de Ciencia y Tecnología de Austria (IST Austria) en Klosterneuburg, Austria ahora ha determinado la primera estructura atómica del representante de la familia V / A-ATPase, llenando el vacío en el árbol evolutivo de estas máquinas moleculares esenciales. Estos resultados obtenidos utilizando los últimos métodos de microscopía crioelectrónica revelaron una estructura similar de la enzima en turbina o molino de agua y ahora se han publicado en la revista. Ciencias .
Poder rotatorio
Las ATP sintasas / ATPasas son grandes complejos de proteínas de membrana que comparten planos generales de construcción bruta y mecanismos de catálisis rotatoria. Esta familia de proteínas incluye la enzima de tipo F que se encuentra en las mitocondrias (fábricas de energía de la célula), cloroplastos (orgánulos que realizan la fotosíntesis en las plantas) y bacterias; El tipo V (vacuolar) que se encuentra en los compartimentos intracelulares en eucariotas (organismos superiores con un núcleo) y el tipo A (arqueas) que se encuentra en los procariotas:arqueas (microorganismos antiguos) y algunas bacterias.
Diferentes sabores de ATPasas
Las enzimas de tipo F y A generalmente funcionan para producir ATP, impulsado por el flujo de protones a través de la membrana. Las enzimas de tipo V generalmente funcionan a la inversa, usando ATP para bombear protones. Las ATPasas V y A son similares estructuralmente pero se diferencian del tipo F por tener dos o tres tallos periféricos y subunidades proteicas de conexión adicionales entre V1 y Vo. Las enzimas de tipo V probablemente evolucionaron a partir del tipo A y, debido a estas similitudes, el tipo A también se denomina V / A-ATPasa. Algunas bacterias incluso Thermus thermophilus , adquirió una enzima de tipo A. Long Zhou, postdoctorado en el grupo de investigación Sazanov de IST Austria, ha purificado y estudiado esta enzima (ThV1Vo) mediante crio-EM. En contraste con el tipo F, para las ATPasas de tipo V, sólo se determinaron previamente las estructuras de los dominios V1 y Vo aislados. Por lo tanto, no se sabía cómo se acopla V1 a Vo, y faltaba el conocimiento sobre el ciclo catalítico completo.
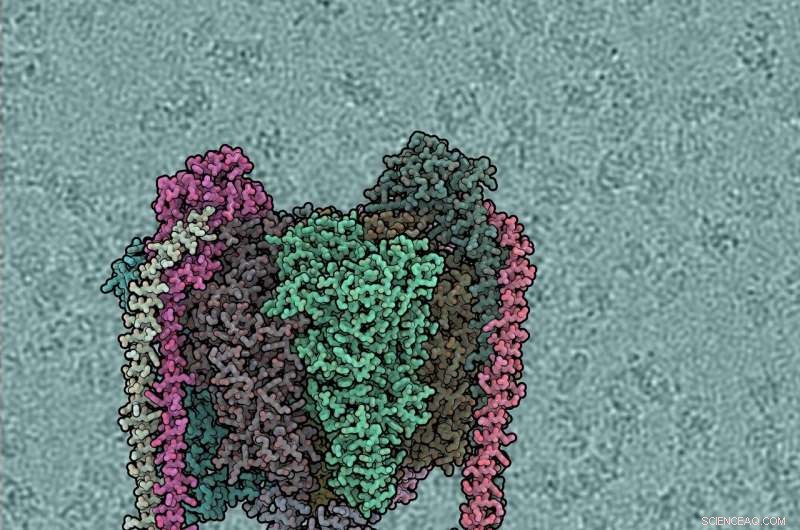
Cada subunidad proteica es de diferente color. El dominio V1 es superior, Vo fondo tallos periféricos a izquierda y derecha. El fondo muestra una micrografía crio-EM cruda, con moléculas de ATPasa individuales visibles. Crédito:IST Austria, 2019
Plasticidad y competencia
Los científicos no determinaron ninguno, pero en total cinco estructuras de la enzima ThV1Vo completa, utilizando métodos de microscopía crioelectrónica desarrollados recientemente en la llamada "revolución de la resolución" de esta técnica. Las estructuras representan varios estados conformacionales de la enzima que se diferencian por la posición del rotor dentro del estator. La plasticidad conformacional global de ThV1Vo se revela como un bamboleo sustancial de V1 en el espacio en la transición de un estado a otro. Es el resultado de la competencia mecánica entre la rotación del rotor central doblado y la rigidez del estator. El acoplamiento V1-Vo se logra mediante una estrecha correspondencia estructural y electrostática entre el eje y la subunidad específica de tipo V que lo une al anillo en C. La visualización de la ruta de los protones reveló diferencias significativas en la distribución de residuos de proteínas cargados con respecto a las F-ATPasas, con un "punto de control" más estricto que evita el "deslizamiento" de la enzima.
¿Por qué complejidad adicional?
En lugar de un solo tallo periférico de enzimas de tipo F, Los tipos A como ThV1Vo tienen dos tallos periféricos, mientras que los tipos V eucariotas tienen tres. Pero, ¿cuál es la ventaja de la complejidad adicional en el conjunto de proteínas ya muy grande? junto con subunidades adicionales que enlazan V1 y Vo? El dominio F1 / V1 tiene una simetría triple, por lo que se produce (o consume) una molécula de ATP por cada rotación de 120 ° del estator dentro de F1 / V1. El profesor Leonid Sazanov dice:"En V / A-ATPases, este paso es una rotación única de 120 °, en contraste con la F-ATP sintasa donde se divide en varios subpasos. Por lo tanto, Es posible que se requiera una mayor plasticidad en ThV1Vo para vincular estos pasos de 120 ° en V1 con pasos de subunidad per c más pequeños en el anillo Vo c12. Esta flexibilidad adicional puede proporcionarse en los tipos V mediante los tallos periféricos adicionales y las subunidades de conexión. Nuestras nuevas estructuras muestran cómo se logra esto, proporcionando un marco para toda la familia V-ATPase ".