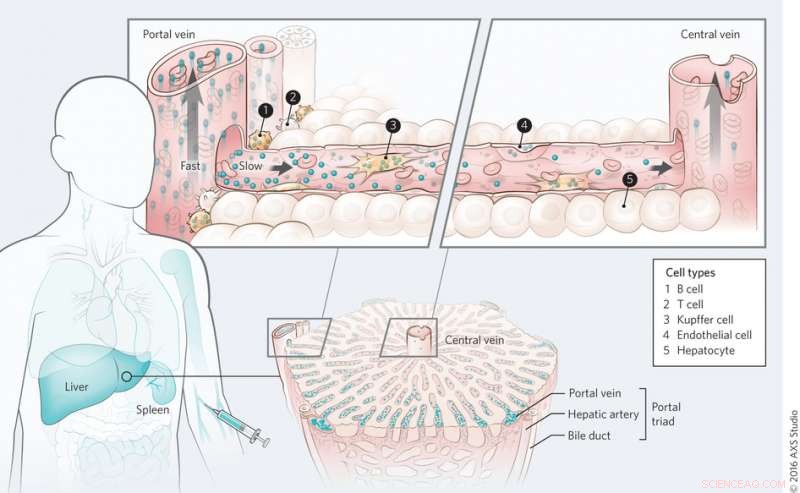
Mecanismo de transporte de nanomateriales en el hígado. Crédito:(c) Kim M. Tsoi, et al. Materiales de la naturaleza (2016) doi:10.1038 / nmat4718
(Phys.org) —Uno de los mayores desafíos para realizar el potencial de las terapias dirigidas es evitar que los nanomateriales se acumulen en el hígado o el bazo. El hígado y el bazo forman parte del sistema de fagocitos mononucleares. Su función es filtrar las toxinas del torrente sanguíneo. Desafortunadamente, en hacer su trabajo, también evita que las nanoterapias alcancen su objetivo.
Para superar este obstáculo, un grupo de investigadores de varias instituciones de Toronto han realizado cálculos computacionales a nivel de órgano y suborganismo, in vitro, y estudios in vivo utilizando puntos cuánticos, nanopartículas de oro, y nanopartículas de sílice para comprender mejor el sistema de fagocitos mononucleares y el mecanismo por el cual se secuestran las nanopartículas. Descubrieron que la tasa de flujo sanguíneo, fenotipo celular, y la posición física en el hígado juegan un papel en la absorción de nanopartículas. Sugieren que el trabajo futuro debería involucrar no solo el diseño de nanopartículas, pero una especie de preacondicionamiento del hígado. Su trabajo aparece en Materiales de la naturaleza .
Las nanopartículas se pueden funcionalizar de tal manera que la partícula se dirija a un tipo de célula particular. Esto es muy prometedor para el cáncer y otras terapias dirigidas. Sin embargo, cuando las nanoterapias se prueban en el cuerpo, la nanopartícula se elimina del torrente sanguíneo a través del sistema de fagocitos mononucleares (MPS). Esto es válido para todos los tipos de nanopartículas.
Tsoi, et al. llevó a cabo análisis de órganos completos y suborganismos para comprender mejor cómo el sistema MPS secuestra nanopartículas. Por sus experimentos, se centraron en nanopartículas "duras" no degradables:puntos cuánticos, nanopartículas de oro, y nanopartículas de sílice.
En todo el nivel de órganos, Tsoi, et al. encontraron que los puntos cuánticos son eliminados primero por las células cercanas a la tríada portal y que hay un gradiente de eliminación a través del sinusoide hepático durante el primer paso. La sangre fluye hacia el hígado a través de la tríada portal y sale por la vena central. Esto también se observó con nanopartículas de oro independientemente de la funcionalización de la superficie, aunque la adsorción de proteínas parece jugar un papel en la absorción de nanopartículas.
La siguiente área de investigación es si la tasa de flujo sanguíneo juega un papel en el secuestro de nanopartículas. El flujo sanguíneo se ralentiza una vez que llega al hígado (de 10 a 100 cm s -1 hasta 200-800 μm s -1 ). Tsoi, et al. desarrolló un modelo matemático para describir el flujo sanguíneo dentro del hígado y la probabilidad de secuestro de nanopartículas. Luego compararon sus resultados computacionales con los resultados de los estudios de citometría con las ratas que fueron tratadas con puntos cuánticos en la prueba de acumulación de nanopartículas. Notablemente, mientras que la advección es la influencia dominante en el flujo sanguíneo en el cuerpo, la difusión es la influencia dominante en el hígado. Encontraron que el hígado tenía 10 2 a 10 3 veces más probabilidades de secuestrar nanomateriales y ese tamaño de partícula jugó un papel:cuanto más grande es la partícula, es más probable que sea absorbido por el hígado.
A nivel de sub-órganos, Tsoi, et al. analizó qué tipos de células desempeñan el papel más importante en la absorción de nanopartículas. Los estudios para determinar la absorción celular de puntos cuánticos mostraron que las células de Kupffer adsorbieron el mayor volumen de puntos cuánticos, como se esperaba. Sin embargo, lo sorprendente fue el número de partículas internalizadas por las células B. Las células B parecen desempeñar un papel mucho más importante en la absorción de nanopartículas de lo que se pensaba, aunque las células de Kupffer siguen siendo las células clave en la eliminación de nanopartículas. Otros tipos de células, incluidas las células endoteliales, también jugó un papel en la eliminación de nanopartículas.
Próximo, Tsoi, et al. probaron si la arquitectura del órgano afecta la captación de nanopartículas en el hígado mediante el estudio del proceso de secuestro en el bazo. Encontraron que de las nanopartículas que fueron eliminadas por el bazo, casi todos ellos se ubicaron en la región de la pulpa roja. Aquí es donde el flujo sanguíneo disminuye en comparación con el flujo en todo el cuerpo. Si bien algunas nanopartículas residían en el bazo, los macrófagos del bazo internalizaron menos nanopartículas que las células de Kupffer dentro del hígado. Esto se confirmó con estudios comparativos in vitro e in vivo, y demuestra que el tipo celular de la arquitectura del órgano juega un papel en la captación de nanopartículas.
Esta investigación proporciona información importante sobre cómo superar la absorción de nanopartículas por el MPS. Normalmente, los investigadores se centran en el diseño de nanopartículas, pero este estudio sugiere que el entorno corporal juega un papel importante en el secuestro de nanopartículas. Los autores sugieren manipular el entorno del anfitrión como una estrategia complementaria a la optimización de nanopartículas. Las pruebas preliminares muestran que dos posibles vías son cambiar la tasa de flujo sanguíneo a través del hígado y cambiar el fenotipo de ciertas células para que no sean propensas a la absorción de nanomateriales.
© 2016 Phys.org