
Muchas bacterias y arqueas se encierran dentro de una capa protectora de autoensamblaje de proteínas de la capa S, como una armadura de cota de malla. El proceso es un modelo para el autoensamblaje de nanoestructuras orgánicas e inorgánicas 2D y 3D.
Imagínese miles de copias de una sola proteína organizándose en una capa de armadura de cota de malla que protege al usuario de las duras y cambiantes condiciones ambientales. Ese es el caso de muchos microorganismos. En un nuevo estudio, Investigadores del Laboratorio Nacional Lawrence Berkeley (Berkeley Lab) del Departamento de Energía de EE. UU. (DOE) han descubierto detalles clave en este proceso natural que se pueden utilizar para el autoensamblaje de nanomateriales en estructuras complejas de dos y tres dimensiones.
Caroline Ajo-Franklin, químico y biólogo sintético en la Fundición Molecular de Berkeley Lab, dirigió este estudio en el que se utilizaron mediciones de dispersión de luz de alto rendimiento para investigar el autoensamblaje de nanohojas 2D a partir de una proteína de la capa superficial bacteriana común (capa S). Esta proteína, llamado "SbpA, "forma la armadura protectora de Lysinibacillus sphaericus, una bacteria del suelo que se utiliza como toxina para controlar los mosquitos. Su investigación reveló que los iones de calcio juegan un papel clave en cómo se ensambla esta armadura. En realidad, dos roles clave.
"Los iones de calcio no solo desencadenan el plegado de la proteína en la forma correcta para la formación de nanoláminas, pero también sirven para unir las nanohojas, "Dice Ajo-Franklin." Al establecer y usar la dispersión de luz como un proxy para la formación de nanohojas de SbpA, pudimos determinar cómo la variación de las concentraciones de iones de calcio y SbpA afecta el tamaño y la forma de la armadura de la capa S ".
Los detalles de este estudio se han publicado en la revista ACS Nano en un artículo titulado "Control específico de iones de la dinámica de autoensamblaje de una red de proteínas nanoestructuradas". Ajo-Franklin es el autor correspondiente. Los coautores son Behzad Rad, Thomas Haxton, Albert Shon, Seong-Ho Shin y Stephen Whitelam.
En el mundo microbiano de bacterias y arqueas, abundan las amenazas externas. El entorno que los rodea puede pasar del calor extremo al frío extremo, o de muy ácido a muy básico. Los depredadores están por todas partes. Para protegerse muchas bacterias y arqueas se encierran dentro de una capa de proteínas de la capa S. Si bien los científicos conocen esta capa protectora durante muchos años, cómo se forma ha sido un misterio.
Ajo-Franklin y sus colegas han estado explorando las proteínas autoensambladas como un medio potencial para crear nanoestructuras con estructura y función complejas.
"En la Fundición Molecular, Nos hemos vuelto realmente buenos haciendo nanomateriales en diferentes formas, pero todavía estamos aprendiendo a ensamblar estos materiales en estructuras organizadas. ", dice." Las proteínas de la capa S son abundantes proteínas biológicas que se sabe que se autoensamblan en nanohojas cristalinas 2D con simetrías de celosía y tamaños de poros que tienen aproximadamente las mismas dimensiones que los puntos cuánticos y los nanotubos. Esto los convierte en un sistema modelo convincente para la creación de matrices nanoestructuradas de materiales orgánicos e inorgánicos de forma ascendente ".
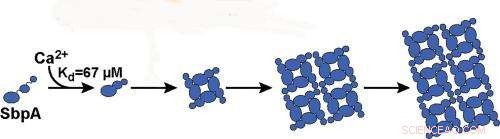
La unión de los iones de calcio a las proteínas SbpA inicia el proceso mediante el cual la SbpA se autoensambla en nanohojas. Ca2 + se une a SbpA con una afinidad de 67 μM. Crédito:Imagen cortesía del grupo Ajo-Franklin, Laboratorio de Berkeley
En este último estudio, Se utilizaron medidas de dispersión de luz para trazar diagramas que revelaron el rendimiento relativo de las nanohojas autoensambladas en una amplia gama de concentraciones de iones de calcio y SbpA. Además, Se examinaron los efectos de la sustitución de iones de calcio por iones de manganeso o bario para distinguir entre un papel catiónico divalente genérico y químicamente específico para los iones de calcio. Behzad Rad, el autor principal de la ACS Nano papel, y compañeros de trabajo siguieron la dispersión de luz por luz en el espectro visible. Luego correlacionaron la señal con la formación de nanohojas mediante el uso de microscopía electrónica y Dispersión de rayos X de ángulo pequeño (SAXS), una tecnología que puede proporcionar información sobre ensamblajes moleculares en casi cualquier tipo de solución. Las mediciones de SAXS se obtuvieron en la "línea de luz SIBYLS (12.3.1) de la fuente de luz avanzada de Berkeley Lab".
"Aprendimos que solo los iones de calcio desencadenan el proceso de autoensamblaje de SbpA y que las concentraciones de iones de calcio dentro de la célula son demasiado bajas para que se formen nanohojas". lo cual es bueno para la bacteria, ", dice Rad." También encontramos que la evolución en el tiempo de los rastros de dispersión de la luz es consistente con el crecimiento irreversible de las hojas de un núcleo insignificantemente pequeño. Tan pronto como cinco iones de calcio se unan a una proteína SbpA, el proceso comienza y el cristal crece muy rápido. El pequeño núcleo es lo que hace que funcione nuestra técnica de dispersión de luz ".
Ajo-Franklin, Rad y sus coautores creen que su técnica de dispersión de luz es aplicable a cualquier tipo de proteína que se autoensambla en nanohojas 2D, y se puede usar para monitorear el crecimiento desde la escala nanométrica hasta la micrométrica.
Dada la naturaleza robusta de las proteínas de la capa S y su calidad adhesiva (las bacterias usan su armadura de la capa S para adherirse a su entorno), hay muchas aplicaciones interesantes que esperan un estudio más a fondo.
"Un proyecto que estamos explorando es el uso de proteínas SbpA para fabricar nanoestructuras adhesivas que podrían usarse para eliminar metales y otros contaminantes del agua, ", Dice Ajo-Franklin." Ahora que tenemos un buen manejo de cómo se autoensamblan las proteínas SbpA, nos gustaría empezar a mezclarlos y combinarlos con otras moléculas para crear estructuras nuevas y útiles ".