El átomo es la unidad más básica de cualquier elemento que aún mantiene las propiedades de ese elemento. Debido a que los átomos son demasiado pequeños para verlos, su estructura siempre ha sido un misterio. Durante miles de años, filósofos y científicos han propuesto teorías sobre la composición de esta misteriosa partícula, con grados crecientes de sofisticación. Aunque había muchos modelos, cuatro principales nos llevaron a nuestro concepto actual del átomo.
El modelo de pudín de ciruela
El llamado modelo de pudín de ciruela fue propuesto por el científico J.J. Thomson en 1904. Este modelo fue concebido después del descubrimiento de Thomson del electrón como una partícula discreta, pero antes de que se entendiera que el átomo tenía un núcleo central. En este modelo, el átomo es una bola de carga positiva, el pudín, en el que se encuentran los electrones, las ciruelas. Los electrones giran en trayectorias circulares definidas dentro de la burbuja positiva que constituye la mayoría del átomo.
Modelo planetario
Esta teoría fue propuesta por el químico ganador del Premio Nobel Ernest Rutherford en 1911 y a veces se le llama el Modelo Rutherford. Basado en experimentos que mostraron que el átomo parecía contener un pequeño núcleo de carga positiva, Rutherford postuló que el átomo consistía en un núcleo pequeño, denso y cargado positivamente, alrededor del cual los electrones orbitaban en anillos circulares. Este modelo fue uno de los primeros en proponer la extraña idea de que los átomos están compuestos principalmente de espacio vacío a través del cual se mueven los electrones.
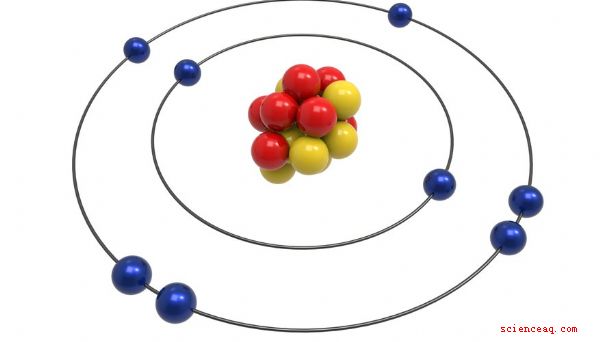
Modelo de Bohr
El modelo de Bohr fue ideado por Neils Bohr, un físico de Dinamarca que recibió el premio Nobel por su trabajo en el átomo. De alguna manera, es una mejora más sofisticada del modelo Rutherford. Bohr propuso, al igual que Rutherford, que el átomo tenía un núcleo pequeño y positivo donde residía la mayor parte de su masa. Declaró que los electrones orbitaban alrededor de este núcleo como planetas alrededor del sol. La principal mejora del modelo de Bohr fue que los electrones estaban confinados para establecer órbitas alrededor del núcleo, cada uno con un nivel de energía específico, lo que explicaba observaciones experimentales como la radiación electromagnética.
Electron Cloud Model
La nube de electrones El modelo es actualmente el modelo más sofisticado y ampliamente aceptado del átomo. Conserva el concepto del núcleo de los modelos de Bohr y Rutherford, pero introduce una definición diferente del movimiento de los electrones alrededor del núcleo. El movimiento de electrones alrededor del núcleo en este modelo está definido por regiones donde hay una mayor probabilidad de encontrar el electrón en un momento dado. Estas regiones de probabilidad alrededor del núcleo están asociadas con niveles de energía específicos y toman una variedad de formas extrañas a medida que aumenta la energía de los electrones.