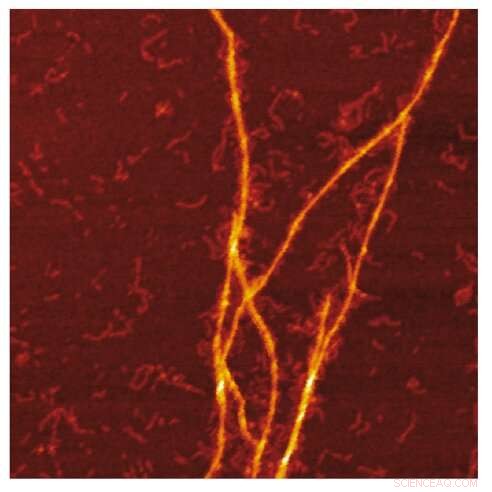
Imagen AFM de la plantilla amiloide de fibrillas S100A9 en la superficie de fibrillas Aβ. Crédito:Jonathan Pansieri
Un equipo de investigación dirigido por Ludmilla Morozova Roche en la Universidad de Umeå, Suecia, ha proporcionado una visión mecanicista de la coagregación de proteínas en la enfermedad de Alzheimer. El mecanismo de plantilla de los amiloides S100A9 en las superficies fibrilares de Aβ durante el proceso de coagregación se reveló por la sinergia de los métodos biofísicos, incluida la espectrometría de masas de detección de carga, microscopía, análisis cinéticos y microfluídicos.
La formación de amiloide es de importancia clínica clave, ya que este proceso está involucrado en numerosas enfermedades neurodegenerativas como el Alzheimer, Parkinson y otros. Estas enfermedades afectan a millones de personas que envejecen en todo el mundo. A menudo es difícil trazar la línea entre estas enfermedades o pueden ocurrir simultáneamente, lo que se conoce como comorbilidad de la enfermedad.
Si bien el proceso de formación de amiloide se estudió ampliamente, poco se sabe sobre los mecanismos específicos de coagregación de diferentes especies amiloides juntas, subyacente a la comorbilidad de las enfermedades. En la enfermedad de Alzheimer, la cascada amiloide-neuroinflamatoria se manifiesta en la coagregación de Aβ con la proteína proinflamatoria S100A9, que conduce al ensamblaje amiloide intracelular y extracelular, deposiciones de placa amiloide y toxicidad celular.
Descifrar las interacciones entre la proteína proinflamatoria S100A9 y el péptido Aβ42 en la enfermedad de Alzheimer es fundamental ya que la inflamación juega un papel central en el inicio de la enfermedad. Aquí, los investigadores utilizan una innovadora espectrometría de masas de detección de carga (CDMS) junto con técnicas biofísicas para proporcionar una visión mecanicista del proceso de coagregación y diferenciar los complejos amiloides a un nivel de partícula única.
La combinación de distribuciones de masa y carga de los amiloides junto con la reconstrucción de las diferencias entre ellos y la microscopía detallada revela que la coagregación implica la formación de plantillas de fibrillas S100A9 en la superficie de los amiloides Aβ42. El análisis cinético corrobora además que las superficies disponibles para la nucleación secundaria de Aβ42 están disminuidas debido al recubrimiento de amiloides S100A9, mientras que la unión de S100A9 a fibrillas de Aβ42 se valida mediante un ensayo microfuídico.
Los investigadores demuestran que la sinergia entre CDMS, microscopía, Los análisis cinéticos y microfuídicos abren nuevas direcciones en la investigación interdisciplinaria.