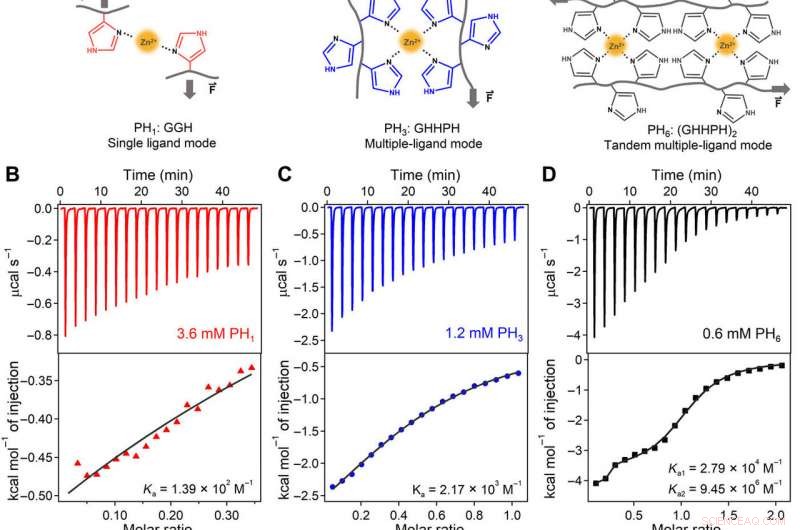
Ingeniería de cooperatividad, constantes vinculantes, y mecanismo molecular de las interacciones de coordinación de iones metálicos a nivel molecular para la carga. (A) Los complejos de coordinación de iones metálicos formados por ligandos simples (PH1, izquierda) son dinámicos y débiles. Al formar un sitio de quelación de metales compuesto por múltiples ligandos (PH3, medio), la unión de iones metálicos se vuelve mucho más fuerte y menos dinámica que la de los ligandos individuales. Es más, al organizar dos sitios de quelación de metales en tándem (PH6, Derecha), la afinidad de unión, fuerza mecánica, y la tasa de asociación se puede mejorar debido a la cooperación entre los dos sitios. (B a D) Datos de titulación ITC de PH1 (izquierda), PH3 (medio), y péptidos PH1 (derecha) con ZnCl2 en tampón tris 1 M (pH 7.60, que contiene KCl 300 mM) a 25 ° C. (E) Constantes de unión de Zn2 + (Ka) de péptidos PH3 y PH3 mutados. Los aminoácidos mutados están resaltados en rojo. Las barras de error representan los errores de ajuste. (F) Constantes de unión de Zn2 + de PH6 y péptidos de PH6 mutados. Los paneles izquierdo y derecho corresponden a Ka1 y Ka2 para los dos sitios de unión de PH6. Solo los péptidos PH6 y (GHHGH) 2 exhibieron dos constantes de unión. El resto de los péptidos mostró características de unión a un solo sitio. Las barras de error representan los errores de ajuste. (G a J) espectros de CD de (G) PH1:GGH; (H) PH3:GHHPH; (I) PH6:(GHHPH) 2; y péptidos (J) (GHHGH) 2 en ausencia y presencia de iones Zn2 +. Los contenidos relativos de las estructuras PPII de PH1 y PH3 son 9,6 y 34,2% según la altura del pico principal de CD a 205 nm, asumiendo que el complejo PH6-Zn2 + muestra una estructura helicoidal 100% PPII. (K) Ilustración esquemática del mecanismo cooperativo de unión de Zn2 + de PH6. El cambio conformacional del primer sitio de coordinación conduce a cambios estructurales del segundo a una conformación que favorece más la unión de Zn2 +. N / A, no aplica. Crédito:Science Advances, doi:10.1126 / sciadv.aaz9531
Los tejidos que soportan cargas, como los músculos y los cartílagos, suelen mostrar una alta elasticidad, dureza y tasas de recuperación rápidas. Sin embargo, La combinación de estas propiedades mecánicas en el laboratorio para construir biomateriales sintéticos es un desafío fundamental. En un nuevo estudio ahora publicado en Avances de la ciencia , Wenxu Sun y un equipo de investigación en física, ingeniería mecánica y dispositivos inteligentes en China, desarrolló un fuerte, hidrogel resistente y de rápida recuperación. El equipo diseñó el material utilizando reticuladores con interacciones dinámicas cooperativas. Diseñaron un decapéptido rico en histidina (cadena de 10 aminoácidos) que contiene dos motivos de unión de zinc (Zn) en tándem (consecutivos) para facilitar la estabilidad termodinámica, fuerza de unión más fuerte y velocidad de unión más rápida de la construcción, en comparación con motivos de proteína de unión única o proteínas de ligando aisladas. Los hidrogeles de red híbrida diseñados con el complejo peptídico de zinc exhibieron una alta estabilidad, dureza y rápida recuperación en segundos. El equipo de investigación espera que los andamios administren de manera efectiva las aplicaciones de ingeniería de tejidos que soportan cargas y funcionen como bloques de construcción para la robótica blanda. Los nuevos resultados proporcionan una ruta general para ajustar las propiedades mecánicas y dinámicas de los hidrogeles a nivel molecular.
Cuando caminamos nuestros músculos, el cartílago y los tendones están sujetos a cargas mecánicas sustanciales, pero los tejidos biológicos pueden recuperarse rápidamente para funcionar de manera confiable durante muchos ciclos mecánicos. Los bioingenieros han explorado hidrogeles blandos con propiedades mecánicas parecidas a los músculos como actuadores biomecánicos, cartílago sintético, musculo artificial, piel iónica y en robótica blanda. Han dedicado muchos esfuerzos a mejorar la resistencia mecánica y la tenacidad de los hidrogeles mediante la introducción de mecanismos especiales de disipación de energía. La recuperación rápida también es un rasgo único para los tejidos blandos que soportan cargas, además de la resistencia mecánica y la tenacidad, pero los hidrogeles sintéticos todavía carecen de un mecanismo para una rápida recuperación. Por ejemplo, Los hidrogeles tradicionales de doble red (DN) o de red híbrida (HN) con cadenas de polímero cortas, ya que las redes de sacrificio normalmente no pueden recuperarse pronto, a menudo demorando de minutos a días.
La fuerza de un hidrogel depende de la vida útil de sus reticulantes, donde la cinética de unión / desvinculación lenta conduce a hidrogeles fuertes, mientras que los tipos de cambio rápidos producen unos suaves. Para obtener una alta resistencia y tenacidad, los reticulantes deben ser lentos, pero para lograr una rápida recuperación, los reticulantes deben ser dinámicos con altas tasas de asociación y disociación. Para superar esta contradicción, Los materiales que soportan cargas de origen natural han utilizado la cooperatividad de interacciones débiles. En este trabajo, Sun y col. hidrogeles de red híbrida (HN) de ingeniería similar con un complejo péptido-metal diseñado específicamente como reticulante físico. El equipo formó sitios de unión de metales eficientes en una secuencia de péptidos para diseñar hidrogeles con las características necesarias.
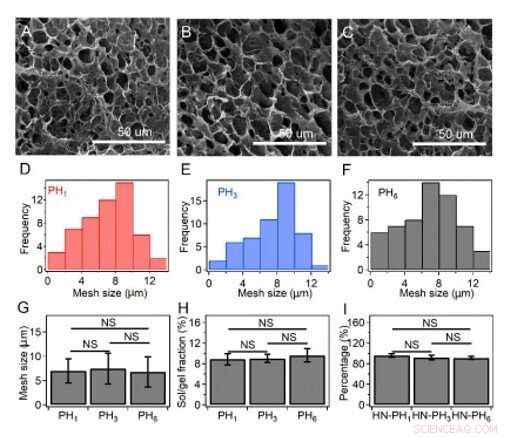
Tamaño de malla, fracciones sol / gel, y el porcentaje real de péptidos que se incorporan a la red de hidrogel. (A-C) Imágenes SEM del gel HN-PH1 (A), el gel HN-PH3 (B) y el gel HN-PH3 (C) antes de agregar los iones Zn2 +. (D-F) Distribuciones de tamaño de malla del gel HNPH1 (D), Gel HN-PH3 (E) y gel HN-PH6 (F) estimados a partir de las imágenes SEM utilizando el software ImageJ. (G) Tamaño de malla medio de los geles de HN-PHn en ausencia de iones Zn2 +. (H) Fracciones sol / gel de diferentes geles de HN-PHn antes de agregar zinc. (I) El porcentaje de péptidos que se incorporan en la red de hidrogel. Las concentraciones iniciales de péptidos fueron 0,3 M, 0,10 M, y 0.05 M para PH1, PH3, y PH6, respectivamente. El porcentaje de péptidos que se incorporaron a los hidrogeles fue similar, según se estima restando la fracción de péptidos eluidos de la cantidad total utilizada. Las barras de error indican la media ± S.D. NS:p> 0,05. Crédito:Science Advances, doi:10.1126 / sciadv.aaz9531
El equipo diseñó primero tres péptidos cortos ricos en histidina (péptidos HR) como ligandos para unirse con iones de zinc (Zn 2+ ) y construir hidrogeles de HN. Denotaron las secuencias de péptidos como PH 1 , PH 3 y PH 6 basado en el número de histidinas enlazadas. Sun y col. sintetizó los péptidos mediante síntesis de péptidos en fase sólida y los purificó con cromatografía líquida de alta resolución. Observaron la formación de Zn 2+ complejos de coordinación de histidina mediante espectroscopia ultravioleta (UV) y Raman. La secuencia de péptidos diseñada específicamente permitió Zn sinérgico y cooperativo 2+ afinidad de unión, en comparación con péptidos con residuos de histidina aleatorios en sus secuencias. Los científicos estudiaron el mecanismo molecular de la unión cooperativa del ión zinc al PH 6 usando dicroísmo circular, los resultados sugieren cambios conformes del primer sitio de coordinación de PH 6 para ser crítico para la vinculación cooperativa y mostró cómo los cambios estructurales favorecieron Zn adicional 2+ vinculante.
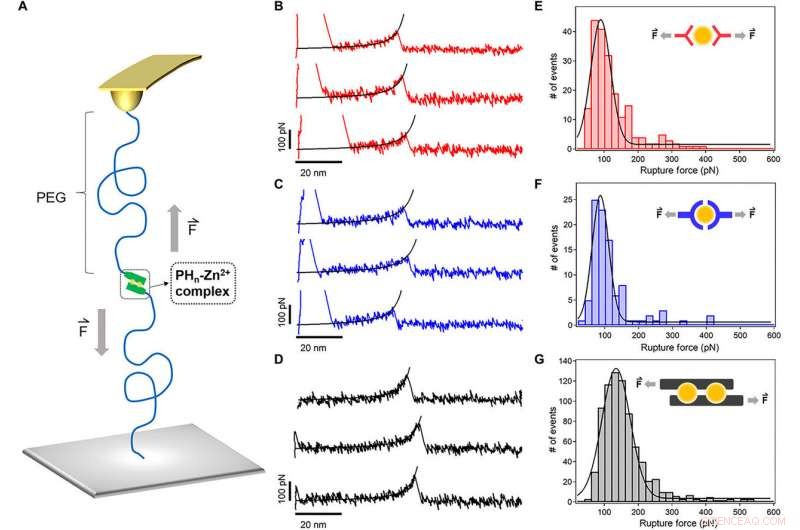
Espectroscopía de fuerza de una sola molécula de los complejos de coordinación de iones metálicos. (A) Diagrama esquemático de los experimentos de espectroscopia de fuerza de una sola molécula basados en AFM. Los ligandos peptídicos se enlazaron a la punta en voladizo y al sustrato mediante un enlazador PEG (MW, 5 kDa). (B a D) Curvas típicas de fuerza-extensión para la ruptura de PH1-Zn2 + (rojo), PH3-Zn2 + (azul), y complejos PH6-Zn2 + (negro) a una velocidad de tracción de 1000 nm s − 1. El ajuste en cadena en forma de gusano de las curvas de fuerza-extensión (líneas negras) confirmó que el pico en una extensión de ~ 50 nm corresponde a la ruptura de un enlace de quelación de iones metálicos individuales. (E a G) Los histogramas de fuerza de ruptura para PH1-Zn2 + (rojo), PH3-Zn2 + (azul), y PH6-Zn2 + (negro), respectivamente. El ajuste gaussiano muestra las fuerzas de ruptura promedio de 90 ± 29, 87 ± 24, y 135 ± 41 pN, respectivamente. Los modos de unión de iones Zn2 + propuestos para los tres péptidos se muestran en los recuadros. Crédito:Science Advances, doi:10.1126 / sciadv.aaz9531
Sun y col. utilizó técnicas avanzadas como la espectroscopía de fuerza de una sola molécula (SMF) basada en microscopía de fuerza atómica (AFM) para medir la estabilidad mecánica del péptido HR-Zn 2+ complejos, es decir, reticulantes del hidrogel a nivel molecular. Las fuerzas de ruptura promedio fueron mucho más altas para PH 6 en comparación con otros tipos de hidrogeles, confirmando la tenacidad del hidrogel. Los resultados mostraron que la estabilidad mecánica de los complejos metal-ligando podría mejorarse considerablemente basándose en los sitios de unión.
The team explored if changes to the intrinsic properties of crosslinkers could alter macroscopic mechanical properties of the hydrogel by preparing a series of hybrid network (HN) hydrogels. They used HR-peptide-Zn 2+ as sacrificial crosslinkers and covalent bonds as permanent crosslinkers in the constructs and named the resulting hydrogels as HN-PH 1 , HN-PH 3 , and HN-PH 6 , based on the peptide sequence used. The network structures were similar in all three hydrogels but the HN-PH 6 gel was more compressible compared to the others, while functioning effectively under stressful mechanical environments. Curiosamente, the scientists could even twist the HN-PH 6 hydrogel into a spiral shape and compress the material with a sharp blade without causing it permanent damage.

Compressing the HN-PH6 hydrogel using a sharp blade does not damage the material. Crédito:Science Advances, doi:10.1126/sciadv.aaz9531
The team conducted tensile mechanical tests on the gels and correlated the results on the bulk level with those at the molecular level, to show remarkably higher break strain, Young's modulus and toughness for the HN-PH 6 geles. Sun et al. then examined the recovery property of the material based on loading-unloading cycles and found HN-PH 6 gels to almost totally recover its macroscopic mechanical properties in minutes. Sin embargo, if they cut up the HN-PH 6 gels into pieces, the hydrogel could not self-heal since covalent crosslinkers do not reform after fracture. To understand the experimental outcomes, the research team also conducted theoretical analyses and proposed cooperative zinc binding on PH 6 to be an important factor, among other factors to form strong and tough hydrogels with fast recovery rates.
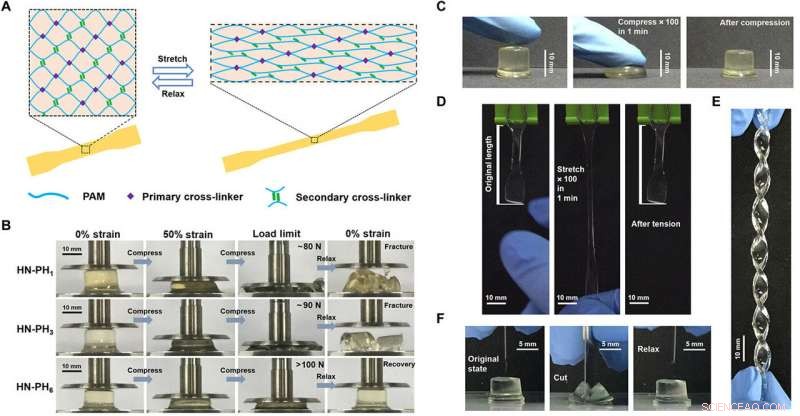
Structure and properties of HN-PHn HN hydrogels cross-linked by the peptide-Zn2+ coordination complexes. (A) Schematic illustration of the network structure of HN-PHn hydrogels. The network comprises covalent bonds as the primary cross-linkers and ligand-metal interactions as the secondary cross-linkers. (B) Optical images of the HN-PH1 (top), HN-PH3 (middle), and HN-PH6 (bottom) hydrogels under a compression-relaxation cycle. The HN-PH1 and HN-PH3 gels were fractured, whereas the HN-PH6 gel was almost fully recovered. (C) Optical images of the HN-PH6 gel under an extreme compressive condition (compressed to>70% strain for 100 times at 1.6 Hz). (D) Optical images of the HN-PH6 gel under an extreme tensile condition (stretched to>150% strain for 100 times at 1.6 Hz). (E) Optical image of the HN-PH6 gel twisted into a spiral shape. (F) Optical images of the HN-PH6 gel compressed with a sharp blade and relaxed. No detectable cut was observed on the gel. PAM, polyacrylamide. Photo credits:Wenxu Sun, Nanjing University. Crédito:Science Advances, doi:10.1126/sciadv.aaz9531
De este modo, Wenxu Sun and colleagues developed a novel hydrogel material, bioinspired by histidine residues found in natural load-bearing materials. Combining such outstanding mechanical properties in the lab has remained a challenge due to the inability to effectively harness the unique metal ion binding properties that are encoded in natural proteins. En este trabajo, Sun et al. used bioinspired Zn 2+ -binding peptide as crosslinkers to form the desired hydrogels at the molecular level, highlighting the importance of cooperative metal coordination during materials synthesis. They intend to examine additional mechanical features, such as adhesion to other tissues, before conducting practical applications in tissue engineering.
© 2020 Science X Network