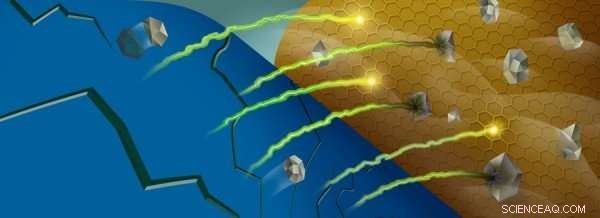
Cuando los iones de manganeso (gris) se eliminan del cátodo de una batería (azul), pueden reaccionar con el electrolito de la batería cerca del ánodo (oro), atrapando iones de litio (verde / amarillo). Crédito:Robert Horn / Laboratorio Nacional Argonne
Como tú, yo y todos los que conocemos, las baterías tienen una vida útil limitada.
Cuando una batería entra en "vejez, "los científicos se refieren a su rendimiento disminuido como" desvanecimiento de la capacidad, "en el que la cantidad de carga que una batería puede suministrar disminuye con el uso repetido. La pérdida de capacidad es la razón por la que una batería de teléfono celular que solía durar un día entero, después de un par de años, durar quizás sólo unas pocas horas.
Pero, ¿y si los científicos pudieran reducir esta capacidad? permitiendo que las baterías envejezcan con más gracia?
"Ahora que conocemos los mecanismos detrás de la captura de iones de litio y la capacidad se desvanece, podemos encontrar métodos para resolver el problema ".
Investigadores del Laboratorio Nacional Argonne del Departamento de Energía de EE. UU. (DOE) identificaron a uno de los principales culpables del desvanecimiento de la capacidad de las baterías de iones de litio de alta energía en un artículo publicado en The Journal of the Electrochemical Society.
Para una batería de iones de litio, del tipo que usamos en las computadoras portátiles, teléfonos inteligentes, y vehículos eléctricos híbridos enchufables:la capacidad de la batería está vinculada directamente a la cantidad de iones de litio que se pueden transportar de un lado a otro entre los dos terminales de la batería a medida que se carga y descarga.
Este transporte está habilitado por ciertos iones de metales de transición, que cambian los estados de oxidación a medida que los iones de litio entran y salen del cátodo. Sin embargo, a medida que se cicla la batería, algunos de estos iones, especialmente el manganeso, se eliminan del material del cátodo y terminan en el ánodo de la batería.
Una vez cerca del ánodo, estos iones metálicos interactúan con una región de la batería llamada interfase de electrolitos sólidos, que se forma debido a reacciones entre el ánodo altamente reactivo y el electrolito líquido que transporta los iones de litio de un lado a otro. Por cada molécula de electrolito que reacciona y se descompone en un proceso llamado reducción, un ion de litio queda atrapado en la interfase. A medida que más y más litio queda atrapado, la capacidad de la batería disminuye.
Algunas moléculas en esta interfase se reducen de forma incompleta, lo que significa que pueden aceptar más electrones y unir aún más iones de litio. Estas moléculas son como yesca esperando una chispa.
Cuando los iones de manganeso se depositan en esta interfase, actúan como una chispa que enciende la yesca:estos iones son eficientes para catalizar reacciones con las moléculas incompletamente reducidas, atrapando más iones de litio en el proceso.
"Existe una correlación estricta entre la cantidad de manganeso que llega al ánodo y la cantidad de litio que queda atrapado, "dijo el coautor del estudio y científico de Argonne Daniel Abraham." Ahora que conocemos los mecanismos detrás de la captura de iones de litio y la capacidad se desvanece, podemos encontrar métodos para resolver el problema ".