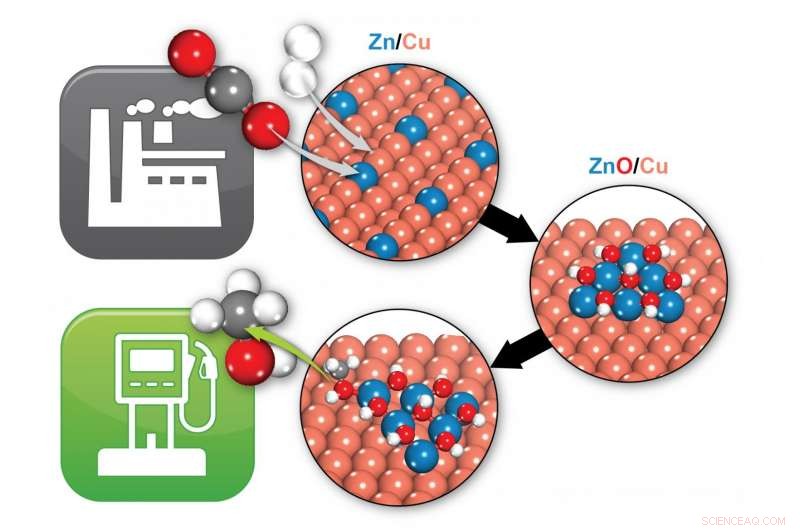
Los científicos de Brookhaven identificaron cómo un catalizador de zinc / cobre (Zn / Cu) transforma el dióxido de carbono (dos bolas rojas y una gris) y el hidrógeno (dos bolas blancas) en metanol (una gris, uno rojo, y cuatro bolas blancas), un combustible potencial. En condiciones de reacción, Zn / Cu se transforma en ZnO / Cu, donde la interfaz entre el ZnO y el Cu proporciona los sitios activos que permiten la formación de metanol. Crédito:Laboratorio Nacional Brookhaven
La captura de dióxido de carbono (CO2) y su conversión en productos químicos útiles como el metanol podría reducir tanto la contaminación como nuestra dependencia de los productos del petróleo. Por tanto, los científicos están muy interesados en los catalizadores que facilitan tales conversiones químicas. Como negociadores moleculares, Los catalizadores unen las sustancias químicas que reaccionan de manera que les resulte más fácil romper y reorganizar sus enlaces químicos. Comprender los detalles de estas interacciones moleculares podría apuntar a estrategias para mejorar los catalizadores para reacciones más eficientes desde el punto de vista energético.
Con ese objetivo en mente, Los químicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. y sus colaboradores acaban de publicar resultados de experimentos y estudios de modelado computacional que identifican definitivamente el "sitio activo" de un catalizador comúnmente utilizado para fabricar metanol a partir de CO2. Los resultados, publicado en la revista Ciencias , resolver un debate de larga data sobre exactamente qué componentes catalíticos participan en las reacciones químicas, y deberían ser el foco de los esfuerzos para mejorar el rendimiento.
"Este catalizador hecho de cobre, óxido de zinc, y óxido de aluminio:se utiliza en la industria, pero no es muy eficiente ni selectivo, "dijo el químico de Brookhaven Ping Liu, el autor principal del estudio, quien también ocupa un puesto adjunto en la cercana Universidad Stony Brook (SBU). "Queremos mejorarlo, y hacer que funcione a temperaturas y presiones más bajas, que ahorraría energía, " ella dijo.
Pero antes de este estudio, diferentes grupos de científicos habían propuesto dos sitios activos diferentes para el catalizador:una parte del sistema con solo átomos de cobre y zinc, o una porción con óxido de cobre y zinc.
"Queríamos saber qué parte de la estructura molecular se une y se rompe y forma enlaces para convertir los reactivos en producto, y cómo lo hace, "dijo el coautor José Rodríguez, otro químico de Brookhaven asociado con SBU.
Descubrir, Rodríguez realizó una serie de experimentos de laboratorio utilizando catalizadores modelo bien definidos, incluido uno hecho de nanopartículas de zinc soportado sobre una superficie de cobre, y otro con nanopartículas de óxido de zinc sobre cobre. Para distinguir a los dos usó un haz de rayos X enérgico para eliminar las muestras, y midió las propiedades de los electrones emitidos. Estas "firmas" electrónicas contienen información sobre el estado de oxidación de los átomos de donde provienen los electrones, ya sea zinc u óxido de zinc.
Mientras tanto Liu, Jingguang Chen de Brookhaven Lab y la Universidad de Columbia, y Shyam Kattel, el primer autor del artículo y un becario postdoctoral co-asesorado por Liu y Chen, usó recursos computacionales en el Centro de Nanomateriales Funcionales (CFN) de Brookhaven y el Centro de Computación Científica de Investigación de Energía Nacional (NERSC), dos instalaciones para usuarios de la Oficina de Ciencias del DOE, para modelar cómo estos dos tipos de catalizadores se involucrarían en las transformaciones de CO2 a metanol . Estos estudios teóricos utilizan cálculos que tienen en cuenta los principios básicos de ruptura y formación de enlaces químicos, incluyendo la energía requerida, los estados electrónicos de los átomos, y las condiciones de reacción, permitiendo a los científicos derivar las velocidades de reacción y determinar qué catalizador dará la mejor velocidad de conversión.
"Descubrimos que el óxido de cobre y zinc debería dar los mejores resultados, y que el cobre zinc ni siquiera es estable en condiciones de reacción, "dijo Liu." De hecho, reacciona con el oxígeno y se transforma en óxido de cobre y zinc ".

Haga ping a Liu y Shyam Kattel con la fuente de rayos X utilizada en este estudio. Crédito:Laboratorio Nacional Brookhaven
Esas predicciones coincidieron con lo que Rodríguez observó en el laboratorio. "Descubrimos que todos los sitios que participaban en estas reacciones eran óxido de cobre y zinc, " él dijo.
Pero no olvides el cobre.
"En nuestras simulaciones, todos los intermediarios de la reacción, los químicos que se forman en la ruta del CO2 al metanol, se unen tanto al óxido de cobre como al óxido de zinc, "Dijo Kattel." Así que hay una sinergia entre el cobre y el óxido de zinc que acelera la transformación química. Necesitas tanto el cobre como el óxido de zinc ".
La optimización de la interfaz cobre / óxido de zinc se convertirá en el principal impulsor del diseño de un nuevo catalizador. dicen los científicos.
"Este trabajo demuestra claramente la sinergia de combinar esfuerzos teóricos y experimentales para estudiar sistemas catalíticos de importancia industrial, ", dijo Chen." Continuaremos utilizando los mismos enfoques combinados en estudios futuros ".
Por ejemplo, dijo Rodríguez, "Intentaremos diferentes configuraciones de los átomos en la interfaz cobre / óxido de zinc para ver cómo afecta eso a la velocidad de reacción. Además, pasaremos de estudiar el sistema modelo a sistemas que serían más prácticos para la industria ".

Jingguang Chen y José Rodríguez (de pie) discuten el mecanismo catalítico con Ping Liu y Shyam Kattel (sentados). Crédito:Laboratorio Nacional Brookhaven
Una herramienta esencial para este próximo paso será la fuente de luz sincrotrón nacional II de Brookhaven (NSLS-II), otra instalación para usuarios de la Oficina de Ciencias. NSLS-II produce haces de rayos X extremadamente brillantes, alrededor de 10, 000 veces más brillante que la fuente de rayos X de laboratorio de haz ancho utilizada en este estudio. Esos intensos haces de rayos X permitirán a los científicos tomar instantáneas de alta resolución que revelen información tanto estructural como química sobre el catalizador. los reactivos, y los intermedios químicos que se forman a medida que ocurre la reacción.
"Y continuaremos ampliando la teoría, "dijo Liu." La teoría apunta a los detalles mecanicistas. Queremos modificar las interacciones en la interfaz cobre / óxido de zinc para ver cómo afecta eso a la actividad y eficiencia del catalizador, y necesitaremos la teoría para seguir adelante con eso también ".