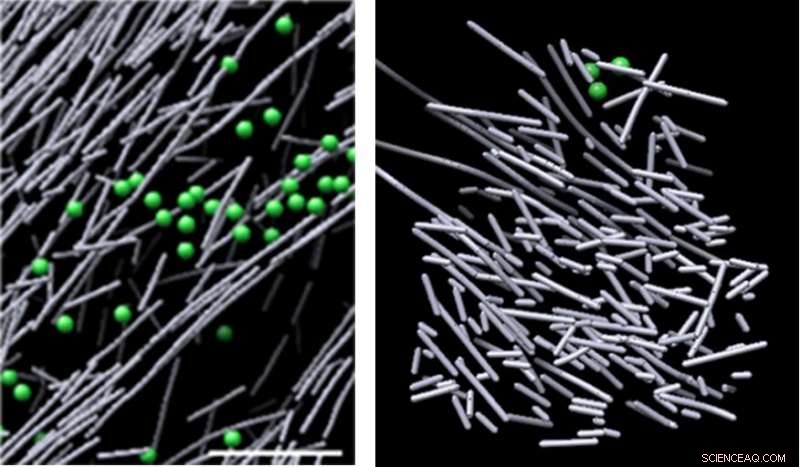
Imágenes de microscopio crioelectrónico del ensamblaje de actina en la célula en ausencia de una señal molecular (izquierda) y el nanoandamio de filamento de actina similar a un pajar que se indujo en respuesta a una señal molecular (Rac1) y promueve el movimiento celular (derecha). La estructura apareció a la vista en regiones definidas donde se activó Rac1, y se disipó rápidamente cuando se detuvo la señalización de Rac1, en tan solo dos minutos y medio. Crédito:Sanford Burnham Prebys Medical Discovery Institute (SBP)
Hay muchas ocasiones en las que nuestras células necesitan moverse. Las células móviles guían la formación de nuestro cuerpo (desarrollo embrionario). Las células inmunes deambulan para capturar intrusos no deseados. Y las células curativas (fibroblastos) migran para curar heridas. Pero no todos los movimientos son deseables:los tumores son más peligrosos cuando las células cancerosas adquieren la capacidad de viajar por todo el cuerpo (metástasis). Ciertas bacterias y virus pueden aprovechar la maquinaria de motilidad de las células para invadir nuestros cuerpos. Comprender cómo se mueven las células y los filamentos de actina en forma de bastoncillos que impulsan el proceso es clave para aprender a detener o promover la motilidad para mejorar la salud humana.
Ahora, utilizando uno de los microscopios más potentes del mundo, Los científicos de Sanford Burnham Prebys Medical Discovery Institute (SBP) y la Universidad de Carolina del Norte en Chapel Hill (UNC-Chapel Hill) han identificado un denso, nanoandamio dinámico y desorganizado de filamentos de actina, que se asemeja a un pajar, que se induce en respuesta a una señal molecular. Esta es la primera vez que los investigadores han visualizado directamente, a nivel molecular, una estructura que se activa en respuesta a una señal celular, un hallazgo clave que amplía nuestra comprensión de cómo se mueven las células. El estudio fue publicado en la procedimientos de la Academia Nacional de Ciencias de los Estados Unidos de América ( PNAS ).
"La microscopía ciroelectrónica está revolucionando nuestra comprensión del funcionamiento interno de las células, "dice Dorit Hanein, Doctor., autor principal del artículo y profesor del Programa de Bioinformática y Biología Estructural de SBP. "Esta tecnología nos permitió recopilar información Imágenes tridimensionales de regiones de células, similares a la resonancia magnética, que crea imágenes detalladas de nuestro cuerpo. Pudimos visualizar células en su estado natural, que reveló una nanoarquitectura de actina nunca antes vista dentro de la célula ".
En el estudio, los científicos utilizaron el microscopio crioelectrónico de SBP (Titan Krios), inteligencia artificial (IA) y enfoques de imágenes celulares y computacionales hechos a medida para comparar imágenes a nanoescala de fibroblastos de ratón con imágenes de luz con marca de tiempo de Rac1 fluorescente, una proteína que regula el movimiento celular, respuesta a la fuerza o tensión (mecanosensibilidad) y la invasión de patógenos. Este flujo de trabajo técnicamente complejo, que unió cinco órdenes de magnitud en escala (decenas de micrones a nanómetros), tardó años en desarrollarse hasta su nivel actual de robustez y precisión y fue posible gracias a los esfuerzos experimentales y computacionales de los equipos de biólogos estructurales de SBP y el equipo de biosensores en UNC-Chapel Hill.
Las imágenes revelaron una densa desestructurado, estructura similar a un andamio compuesta por varillas cortas de actina. Estas estructuras aparecieron a la vista en regiones definidas donde se activó Rac1, y se disipó rápidamente cuando cesó la señalización de Rac1, en tan solo dos minutos y medio. Este andamio dinámico contrasta fuertemente con varios otros ensamblajes de actina en áreas de baja activación de Rac1, algunos compuestos de largos, barras alineadas de actina, y otros compuestos por varillas cortas de actina que se ramifican desde los lados de filamentos de actina más largos. El volumen que encierra el andamio de actina carecía de estructuras celulares comunes, como los ribosomas, microtúbulos, vesículas y más, probablemente debido a la intensa densidad de la estructura.
"Nos sorprendió que experimento tras experimento revelara estos puntos calientes únicos de desalineados, bastoncillos de actina densamente empaquetados en regiones que se correlacionaron con la activación de Rac1, "dice Niels Volkmann, Doctor., un coautor del artículo que dirigió la parte computacional del estudio, y profesor del Programa de Bioinformática y Biología Estructural de SBP. "Creemos que este trastorno es en realidad la fuerza del andamio:otorga la flexibilidad y versatilidad para construir más grandes, arquitecturas complejas de filamentos de actina en respuesta a señales espaciales locales adicionales ".
Próximo, a los científicos les gustaría expandir el protocolo para visualizar más estructuras que se crean en respuesta a otras señales moleculares y desarrollar aún más la tecnología para permitir el acceso a otras regiones de la célula.
"Este estudio es solo el comienzo. Ahora que desarrollamos este flujo de trabajo cuantitativo a nanoescala que correlaciona el comportamiento de señalización dinámica con la resolución a nanoescala de la crio-tomografía electrónica, nosotros y otros científicos podemos implementar esta poderosa herramienta analítica no solo para descifrar el funcionamiento interno del movimiento celular, sino también para dilucidar la dinámica de muchas otras máquinas macromoleculares en un entorno celular imperturbable, "dice Hanein.
Ella agrega, "La actina es una proteína fundamental; interactúa con más de 150 proteínas de unión a actina para generar diversas estructuras, cada uno con una función única. Tenemos un excedente de diferentes señales que nos gustaría mapear, lo que podría proporcionar aún más información sobre cómo se mueven las células ".