La comprensión de sistemas biológicos y biomédicos complejos se ve muy favorecida por las imágenes en 3D, que proporcionan información mucho más detallada que los métodos bidimensionales tradicionales. Sin embargo, la obtención de imágenes de células y tejidos vivos sigue siendo un desafío debido a factores como la velocidad limitada de las imágenes y la dispersión significativa en ambientes turbios.
En este contexto, destacan las técnicas de microscopía multimodal. Específicamente, las técnicas no lineales como CRS (dispersión Raman coherente) utilizan espectroscopía vibratoria óptica, proporcionando imágenes químicas precisas en tejidos y células sin etiquetas.
Además, la microscopía de dispersión Raman estimulada (SRS), un método CRS, puede capturar con precisión imágenes de biomoléculas debido a la relación lineal entre la intensidad de Raman estimulada y la concentración de las moléculas objetivo. Lo hace con alta sensibilidad y sin interferencias de fondos no resonantes no deseados.
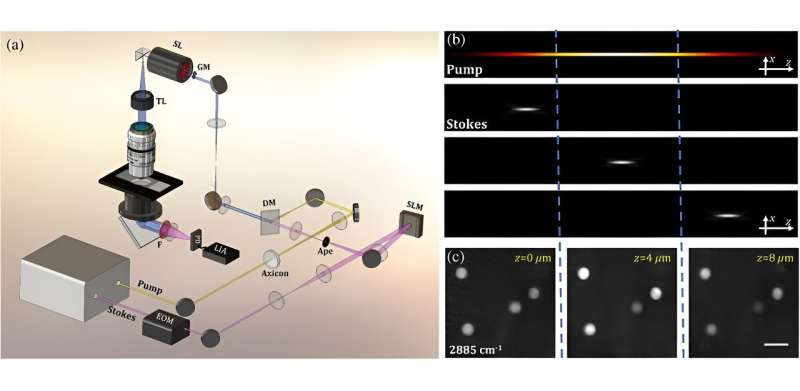
En un estudio reciente publicado en Advanced Photonics , el profesor Zhiwei Huang, director del Laboratorio de Bioimagen Óptica del Departamento de Ingeniería Biomédica de la Facultad de Diseño e Ingeniería de la Universidad Nacional de Singapur, trabajó con su equipo para desarrollar una nueva técnica llamada tomografía de dispersión Raman estimulada de fase modulada (PM- SRST) para la obtención de imágenes químicas en 3D sin etiquetas de células y tejidos.
Según Huang, "este método desarrollado por nosotros permite la adquisición directa de información de muestra 3D en el dominio espacial, sin necesidad de procedimientos de posprocesamiento. También hemos demostrado la utilidad de la técnica PM-SRST para mejorar tanto la resolución lateral como la imagen. profundidad de las imágenes SRS 3D de biotejidos."
En este enfoque, el haz de "bomba" normal del método SRS se sustituye por un haz especializado conocido como haz de Bessel. La posición de otro haz, el haz de Stokes enfocado, se controla mediante un dispositivo llamado modulador de luz espacial a lo largo del haz de bomba de Bessel en la muestra para realizar una sección en z mecánica sin escaneo.
Además, al combinar el haz de bomba de Bessel con un haz de Stokes de longitud de onda más larga, se mejora la capacidad del PM-SRST para manejar la dispersión, lo que permite la captura de imágenes rápidas y detalladas en áreas de tejido más profundas.
La eficacia del método se demostró mediante experimentos que mostraron imágenes químicas volumétricas rápidas y sin etiquetas en diversas muestras. Estos incluyeron el monitoreo en tiempo real del movimiento browniano 3D de perlas de polímero en agua, la observación de los procesos de difusión y absorción de óxido de deuterio (D2 O) en raíces de plantas y estudiando la respuesta bioquímica de las células de cáncer de mama al ácido acético.
Además, se comparó la profundidad de penetración de la luz del PM-SRST con la de las imágenes SRS convencionales. En PM-SRST, la señal de áreas de tejido más profundas es notablemente más fuerte que en C-SRS, lo que lleva a una mejora de aproximadamente el doble en la profundidad de las imágenes.
Huang señala:"La propiedad de seccionamiento óptico sin escaneo z en PM-SRST es universal y se puede extender fácilmente a otras modalidades de imágenes. Por ejemplo, el sistema actual se puede adaptar fácilmente para la dispersión coherente anti-Stokes Raman (CARS) tomografía, y utilizando solo la bomba o el haz de Stokes, la técnica PM-SRST se puede simplificar para facilitar la tomografía de segunda o tercera generación de armónicos, la tomografía multifotónica o la tomografía de fluorescencia".
La técnica PM-SRST, capaz de generar imágenes químicas en 3D de forma rápida y sin etiquetas, se puede utilizar para estudiar actividades metabólicas y procesos dinámicos funcionales relacionados con la administración de fármacos y la terapia dentro de células y tejidos vivos.
Más información: Weiqi Wang et al, Tomografía de dispersión Raman estimulada para obtener imágenes químicas tridimensionales rápidas de células y tejidos, Fotónica avanzada (2024). DOI:10.1117/1.AP.6.2.026001
Proporcionado por SPIE