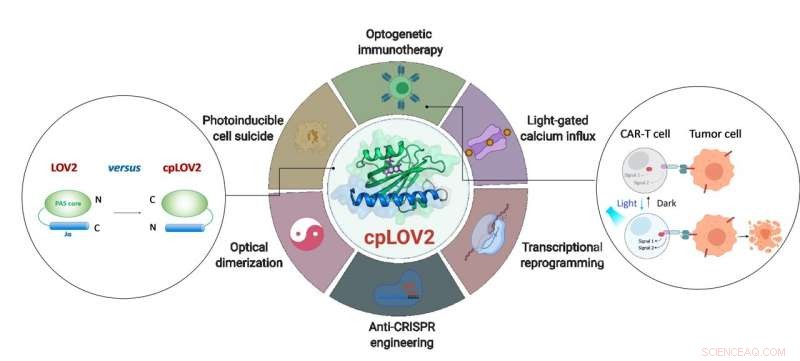
El diseño de cpLOV2 y su aplicación extendida en ingeniería optogenética. Crédito:ZHU Lei
Recientemente, Prof. WANG Junfeng del Laboratorio de Alto Campo Magnético de los Institutos de Ciencias Físicas de Hefei (HFIPS), junto con académicos internacionales, desarrolló un nuevo voltaje circular de luz-oxígeno permutada 2 (LOV2) para expandir el repertorio de interruptores fotográficos codificados genéticamente, lo que acelerará el diseño de nuevos dispositivos optogenéticos. El resultado fue publicado en Biología química de la naturaleza .
El dominio LOV2 es un interruptor fotográfico sensible a la luz azul. En un dispositivo optogenético típico basado en LOV2, un dominio efector se fusiona después de la hélice Jα C-terminal de LOV2, con la intención de enjaular al efector a través de un impedimento estérico en la oscuridad. Sobre la fotoestimulación, El despliegue activado por la luz de la hélice Jα expone el dominio efector para restaurar su función. La elaboración de una proteína fotoconmutable basada en LOV2 a menudo requiere enormes esfuerzos de ingeniería para optimizar cada componente y el enlazador de conexión en el medio. Por lo tanto, Es deseable expandir la caja de herramientas optogenética actual creando nuevos módulos que simplifiquen estos pasos.
En este estudio, los investigadores diseñaron cpLOV2 usando permutación circular, un sólido enfoque de ingeniería de proteínas utilizado anteriormente para desarrollar nuevas variantes de sondas fluorescentes y biocatalizadores codificados genéticamente. Los extremos de nitrógeno (N) y carbono (C) de cpLOV2 se crearon en el extremo N de la hélice Jα, mientras que los antiguos estaban conectados por un enlazador rico en glicina y serina. Por lo tanto, el efector podría fusionarse antes del N-terminal Jα de cpLOV2 además del C-terminal en LOV2.
Utilizando espectroscopia de RMN de alta resolución y otras técnicas, Los investigadores demostraron que la integridad estructural y la función de la disociación Jα de cpLOV2 inducida por la luz se mantienen bien. cpLOV2 también funcionó bien en LOVTRAP y el dímero inducido por luz mejorado (iLid), ambos son sistemas de heterodimerización óptica basados en LOV2.
cpLOV2 proporcionó más opciones para el desarrollo de aplicaciones optogenéticas. Los investigadores generaron una serie de híbridos fusionando LOV2 o cpLOV2 con diferentes Ca 2+ fragmentos de activación y autoinhibición de canales derivados de la molécula de interacción estromal 1, y encontró varios actuadores ópticos novedosos basados en cpLOV2 para controlar ORAI1 Ca 2+ canal, por lo tanto, demostraron que cpLOV2 podría proporcionar nuevas superficies de jaula para superar las limitaciones asociadas con LOV2 de tipo salvaje.
Para los efectores se requiere un terminal N libre para ejecutar su función completa, cpLOV2 es una mejor opción. Una proteína clave involucrada en la necroptosis, proteína similar al dominio de quinasa de linaje mixto (MLKL), fue el exitoso enjaulado y no enjaulado en cpLOV2-MLKL pero no MLKL-LOV2 para el control óptico de suicidios celulares.
La terapia con células T con receptor de antígeno quimérico (CAR) ha surgido como un enfoque inmunoterapéutico prometedor. Sin embargo, la actividad incontrolable de las células CAR T durante la terapia causaría efectos secundarios graves, p. síndrome de liberación de citocinas en algunos pacientes. Los investigadores diseñaron sistemas de heterodimerización óptica basados en cpLOV2 (cpLID), y CAR dividido foto-sintonizable construido (optoCAR). Los linfocitos T optoCAR terapéuticos pueden activarse específicamente mediante el antígeno tumoral CD19 y la luz azul, y luego proliferan para matar CD19 + Células de linfoma Raji.
En modelo de ratón implantado con CD19 + Células Raji, Los investigadores utilizaron nanopartículas de conversión ascendente (UCNP) para convertir la luz infrarroja cercana de alta penetración en el tejido en luz azul y activar las células T optoCAR inyectadas y lograron una terapia altamente eficaz del tumor de linfoma. Las células T OptoCAR desarrolladas en este estudio permiten el control espaciotemporal y reversible de las actividades de las células T y la producción de citocinas.
Estos resultados alentadores sugieren que las células T optoCAR podrían mitigar los posibles efectos secundarios sin perder la eficacia terapéutica. En el futuro, planean probar la inmunoterapia optogenética para tratar diferentes tipos de cáncer.