Los filamentos agrupados se produjeron a partir de los cristales mediante una respuesta al estrés oxidativo de los tioles de cisteinilo después del aislamiento de los cristales de las células vivas. Este método se considerará un avance útil en la ciencia de los nano-materiales biológicos y la química supramolecular como método de síntesis para construir ensamblajes sostenibles utilizando cristales de proteínas. Crédito:Tecnología de Tokio
Las proteínas son, sin duda, algunas de las biomoléculas más fascinantes, y realizan muchas de las funciones que (a nuestros ojos) separan la vida de la materia inanimada. Los conjuntos de proteínas multimoleculares incluso tienen funciones estructurales a gran escala, como lo demuestran las plumas, cabello, y escamas en animales. No debería sorprendernos que, con avances en nanotecnología avanzada y bioingeniería, Los ensamblajes de proteínas artificiales han encontrado aplicaciones en una variedad de campos, incluida la catálisis, almacenamiento molecular, y sistemas de administración de fármacos.
Sin embargo, la producción de conjuntos proteicos ordenados sigue siendo un desafío. Es particularmente difícil obtener monómeros, los componentes básicos de las proteínas, para ensamblar de manera estable en las estructuras deseadas; esto generalmente requiere un diseño y un control muy precisos de las condiciones de síntesis, como pH (acidez) y temperatura. Estudios recientes han encontrado formas de sortear este problema mediante el uso de cristales de proteínas (arreglos moleculares sólidos que ocurren naturalmente en algunos organismos) como matrices precursoras para producir ensamblajes de proteínas.
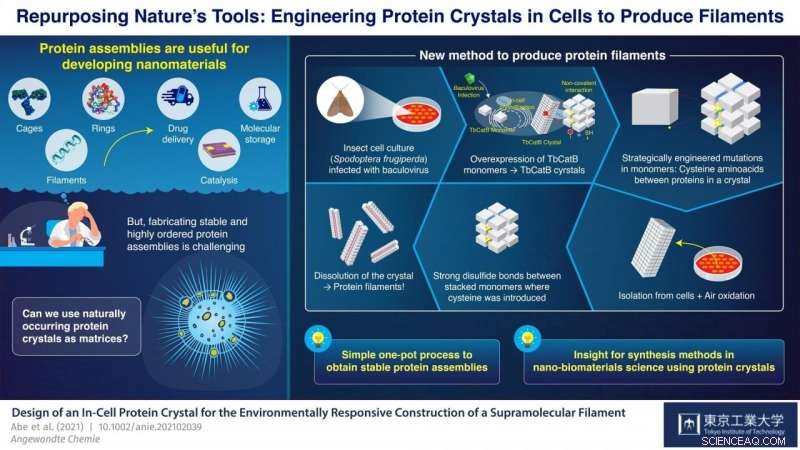
En el Instituto de Tecnología de Tokio, Japón, un equipo de científicos dirigido por el profesor Takafumi Ueno ha estado trabajando en un enfoque prometedor para sintetizar conjuntos de proteínas a partir de cristales de proteínas. Su estrategia consiste en introducir mutaciones en el código genético de un organismo que produce cristales de proteínas de forma natural. Estas mutaciones hacen que se formen enlaces disulfuro (S-S) entre monómeros en ubicaciones muy específicas de los cristales. Luego, los cristales se disuelven, pero en lugar de descomponerse completamente en sus monómeros individuales como de costumbre, los enlaces S-S recién introducidos mantienen juntos grupos de monómeros y los cristales se dividen en muchos de los conjuntos de proteínas deseados. Con este enfoque, El equipo de Ueno ha logrado sintetizar jaulas y tubos de proteínas utilizando esencialmente células vivas como impresoras nano-3D.
En su último estudio, que fue publicado en Edición internacional Angewandte Chemie , el equipo demostró otra aplicación más de su nueva estrategia; esta vez para la síntesis de filamentos de proteína agrupados. Utilizaron un cultivo de células de insectos (Spodoptera frugiperda) infectadas con un virus que causaba la sobreexpresión de un monómero llamado "TbCatB". Estos monómeros se agregan naturalmente dentro de las células en cristales de proteína, que se mantienen juntos allí por las interacciones no covalentes relativamente débiles entre los monómeros. Los científicos introdujeron estratégicamente dos mutaciones en las células para que cada monómero tuviera dos grupos tiol (-SH) de cisteína en puntos críticos de interfaz con otros monómeros.
Los cristales se extrajeron de las células y se dejaron oxidar a temperatura ambiente. lo que provocó que los grupos tiol se transformaran en fuertes enlaces S-S entre monómeros adyacentes a lo largo de una sola dirección por autooxidación bajo el aire. Cuando los cristales se disolvieron, estos enlaces disulfuro, junto con algunas interacciones persistentes no covalentes, resultó en la formación de filamentos de proteína agrupados que tenían dos monómeros de ancho, alrededor de 8,3 nanómetros. "Con nuestra estrategia, Logramos una disposición altamente precisa de las moléculas de proteína mientras suprimimos la agregación aleatoria de monómeros debido a enlaces de sulfuro no deseados. todo en un proceso de un solo recipiente relativamente sencillo, "destaca Ueno.
En general, El enfoque demostrado por el equipo de Tokyo Tech se erige como una forma innovadora de sintetizar estructuras de proteínas a través de la ingeniería genética racional y utilizando las herramientas naturalmente disponibles para las células de ciertos organismos. "Consideramos que nuestro método de síntesis es un avance útil en la ciencia de los nanobiomateriales y la química supramolecular para producir conjuntos estables deseados a partir de cristales de proteínas, ", concluye Ueno. Sólo el tiempo dirá qué otras estructuras moleculares útiles se pueden producir utilizando esta estrategia y qué aplicaciones interesantes encontrarán.