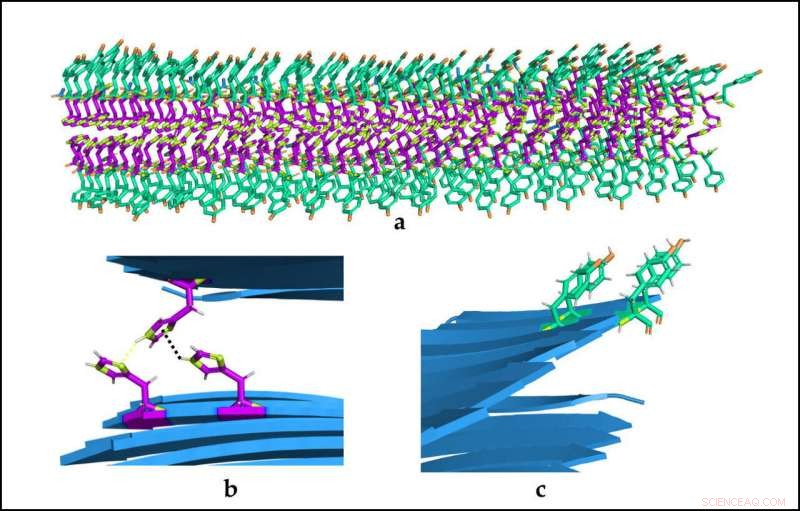
(A) Organización espacial de las bioestructuras catalíticas. (B) y (C) Detalle de los dos tipos de aminoácidos y sus interacciones. Crédito:Universitat Autònoma de Barcelona
Investigadores de la UAB han diseñado bioestructuras minimalistas que imitan enzimas naturales, capaz de realizar dos actividades diferenciadas y reguladas reversiblemente gracias a una combinación única de propiedades estructurales y funcionales. La estrategia utilizada abre la puerta a la creación de nanomateriales "inteligentes" con combinaciones de funciones catalíticas hechas a medida.
Existe un interés creciente en los sistemas sintéticos que pueden ejecutar reacciones químicas bioinspiradas sin requerir las complejas estructuras que caracterizan a las enzimas en sus componentes. Uno de los enfoques más explorados es el autoensamblaje de péptidos, moléculas más pequeñas que las proteínas, debido a su biocompatibilidad y cómo se pueden controlar sus propiedades estructurales y funcionales.
Investigadores del Instituto de Biotecnología y Biomedicina de la Universitat Autònoma de Barcelona (IBB-UAB) diseñaron recientemente una de las estructuras enzimáticas miméticas más pequeñas de la historia. Estos péptidos se componen de siete a nueve aminoácidos que se autoensamblan espontáneamente para formar fibras amiloides estables e hidrogeles sólidos. inocuo para las células.
Los péptidos se forman con solo dos tipos de aminoácidos solubles en agua (tirosina e histidina), un código binario que contiene toda la información necesaria para formar nanoestructuras. Además, son reversibles y pueden realizar dos actividades catalíticas diferenciadas y no relacionadas.
Los investigadores lograron crear un sistema que es más simple y puede controlar mejor la actividad enzimática, y por primera vez una estructura en la que los mismos aminoácidos que proporcionan actividad catalítica también contribuyen a dar forma a la arquitectura macromolecular. En estudios anteriores, estas capacidades se segregaron en diferentes regiones de la molécula, lo que resultó en péptidos más largos y / o péptidos con una sola función.
"El quid de la pregunta es que la actividad catalítica de las fibras y los hidrogeles solo se puede lograr cuando los péptidos se autoensamblan, "explica Salvador Ventura, coordinador del estudio. "La estrategia que utilizamos sienta las bases para la creación de materiales de nanoestructuras" inteligentes ", con combinaciones personalizadas de funciones catalíticas para una serie de aplicaciones prácticas ".
Propiedades únicas
Hasta ahora, la mayoría de los péptidos minimalistas diseñados carecían de una de las capacidades más importantes de las enzimas naturales:la capacidad de regular reversiblemente su actividad. En este estudio, los investigadores lograron controlar la capacidad de montaje, y esto permite alternar formas activas e inactivas con simples cambios de pH.
Además, los nuevos péptidos tienen propiedades que las enzimas naturales no tienen, ya que estos solo realizan actividades catalíticas. Ahora, los péptidos incorporan dos tipos diferentes de actividades (hidrolíticas y electrocatalíticas) que pueden realizarse de forma simultánea o alterna. En cualquier otro caso, esto requeriría dos enzimas artificiales estructuralmente diferentes que serían cientos de veces más grandes y más caras.
Otra característica de estas nuevas enzimas artificiales que señalan los investigadores es la espontaneidad del autoensamblaje, lo que implica que no hay necesidad de reactivos químicos adicionales o la aplicación de calor, lo que podría resultar tóxico o tener efectos drásticos en su estructura.
Mayor eficiencia y economía
Los hidrogeles y las fibras amiloides permiten generar microrreactores sólidos, más eficientes y económicos, en el que el producto final de la reacción se puede separar fácilmente de la enzima artificial.
"Las estructuras macromoleculares que hemos logrado crear pueden tener aplicaciones importantes en microfluídica, y también en la entrega de medicamentos, ya que pueden encapsular el fármaco en su estado ensamblado y liberarlo de una manera específica, una vez que se logra el contexto de celda correcto, simplemente desmontando, Destaca Salvador Ventura.
Salvador Ventura es director del grupo de Enfermedades Conformacionales y Plegamiento de Proteínas del IBB. "Iniciamos las líneas de investigación nanotecnológica hace solo tres años, pero nuestro conocimiento sobre el mecanismo molecular del ensamblaje de proteínas en estructuras amiloides nos ha ayudado a desarrollar nuevas funciones, nanomateriales sintéticos con propiedades que no se pueden lograr con péptidos o proteínas naturales, " él dice.