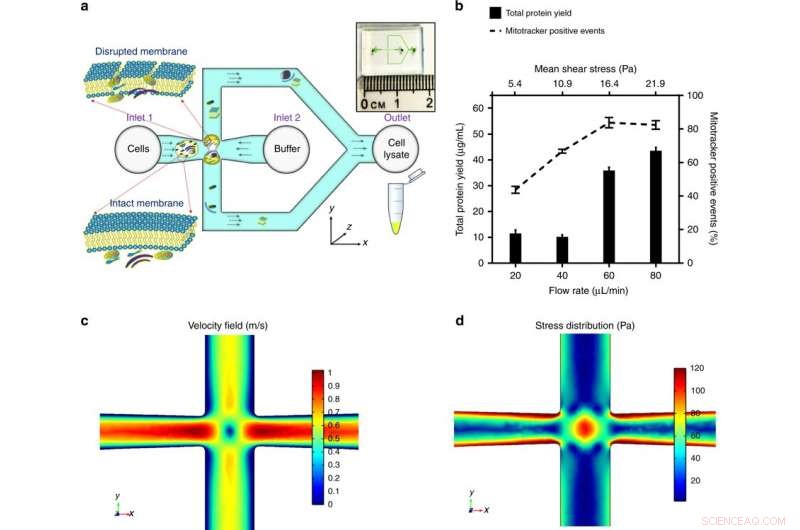
a) Las células se introducen en el cruce del microcanal. El estrés aplicado a la célula está optimizado para romper la membrana celular y liberar componentes subcelulares, manteniendo la integridad de las mitocondrias. La descripción general del chip de microfluidos se muestra en el recuadro. b) La tensión media aplicada, modulado controlando el caudal volumétrico para una geometría de canal determinada, se ha optimizado mediante el rendimiento máximo de proteínas (una indicación de la cantidad de contenido subcelular extraído) y los eventos positivos máximos de mitotracker (un sello distintivo de las mitocondrias funcionales). Los resultados se obtuvieron triturando células HEK293 (células renales embrionarias, 106 células / mL) por un rango de esfuerzo cortante y representado como media ± DE (n =3 experimentos independientes). COMSOL Multiphysics® estableció un modelo de simulación de elementos finitos para ilustrar el flujo fluídico en la unión transversal. Dar un caudal volumétrico a 60 μl / min, c) ilustra el perfil de velocidad y el punto de estancamiento en el centro (donde la velocidad del flujo es cero), yd) ilustra la distribución de esfuerzos y los campos de flujo extensional alrededor del punto de estancamiento, lo que contribuye significativamente a la deformación y rotura celular. Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0037-y.
Las mitocondrias son dinámicas, orgánulos intracelulares bioenergéticos, responsable de la producción de energía a través de la producción de ATP durante la respiración. Están involucrados en tareas metabólicas celulares clave que regulan las respuestas fisiológicas vitales de las células, incluida la señalización celular, diferenciación celular y muerte celular. Las mitocondrias defectuosas están relacionadas con varias enfermedades genéticas humanas críticas, incluidos los trastornos neurodegenerativos, cáncer y enfermedad cardiovascular.
La caracterización detallada de las mitocondrias funcionales permanece relativamente inexplorada debido a la falta de métodos efectivos de extracción de orgánulos. Por ejemplo, el proceso de extracción debe mantener la funcionalidad suficiente del orgánulo ex vivo para iluminar sus funciones citosólicas en presencia del citoesqueleto y otros orgánulos subcelulares. Dado que las mitocondrias crecen en una red reticular compleja dentro de las células para sufrir alteraciones estructurales, su caracterización intracelular es aún más complicada. Como resultado, El análisis in vitro de las mitocondrias sigue siendo el método principal, para extraer y comprender por separado las propiedades intrínsecas de las mitocondrias, sin la interferencia de otros orgánulos subcelulares.
En un estudio reciente, ahora publicado en Microsistemas y nanoingeniería , Habibur Rahman y sus colegas del Departamento de Ingeniería Biomédica exploraron la posibilidad de controlar el estrés hidrodinámico para una extracción mitocondrial eficiente. Para esto, utilizaron geometría de microfluidos de unión cruzada a microescala para interrumpir selectivamente la membrana celular mientras aseguraban la integridad de la membrana mitocondrial.
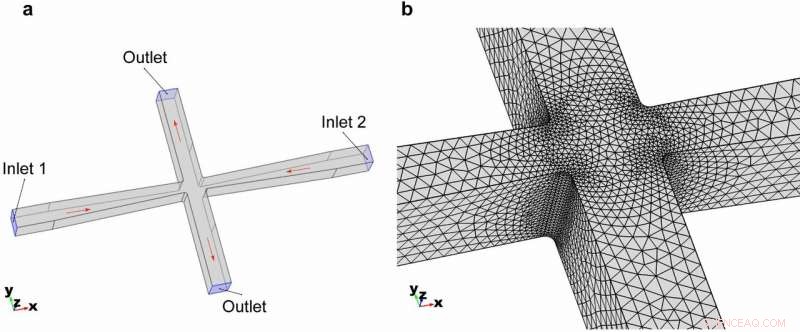
Geometría 3D del canal de microfluidos de ranuras cruzadas. (a) Geometría general y condiciones de contorno del modelo. (b) Mallado de los elementos con el zoom en la región de ranuras cruzadas. Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0037-y
Los avances en microfluidos han demostrado las ventajas de los procedimientos de laboratorio en chip con un tamaño de muestra significativamente reducido y una mayor reproducibilidad experimental. El estrés hidrodinámico producido en chips de microfluidos se puede utilizar para abrir membranas celulares o nucleares de forma transitoria durante la administración intracelular de genes. El potencial de tales técnicas rara vez se ha examinado para extraer orgánulos subcelulares, ya que las geometrías restringidas de los microcanales pueden causar la obstrucción de los componentes subcelulares en las micromáquinas.
Los autores optimizaron las condiciones experimentales de funcionamiento basándose en estudios previos para triturar eficazmente las membranas celulares mientras se retienen las mitocondrias intactas en líneas celulares de mamíferos modelo. Las líneas celulares modelo de interés fueron células renales embrionarias humanas (HEK293), células de músculo de ratón (C2C12) y células de neuroblastoma (SH-SY5Y).
En el principio de funcionamiento de la trituradora de células a microescala propuesta, los científicos midieron la diferencia en el módulo de elasticidad entre la membrana mitocondrial y la membrana celular para romper la célula mientras retiene la membrana mitocondrial. Un mayor nivel de estrés en el sistema podría alterar las membranas celulares con módulos elásticos más altos (como se ve con la línea celular del neuroblastoma). El estudio comparó el rendimiento de proteínas y la concentración de mitocondrias funcionales extraídas utilizando el método propuesto frente a los kits disponibles comercialmente para un rango de concentraciones celulares.
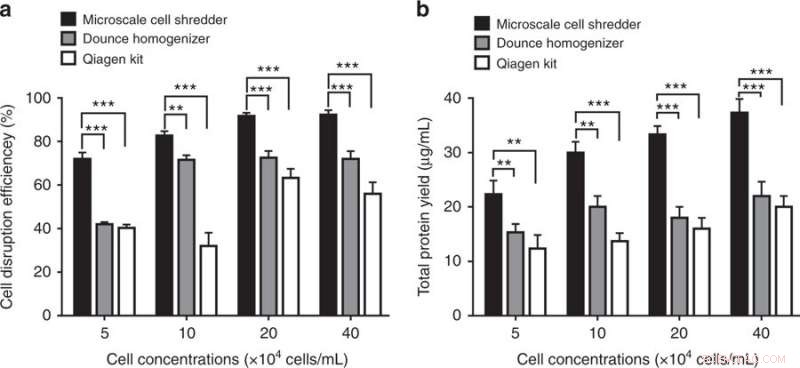
Disrupción celular y eficiencia de extracción de proteínas utilizando la trituradora de células a microescala, el homogeneizador Dounce y el kit de aislamiento de mitocondrias de Qiagen. a) Eficiencia de disrupción celular, determinada por la fracción de células rotas frente al número total de células intactas, se cuantificó a diferentes concentraciones de células. b) Después de los pasos de centrifugación, El rendimiento de proteína total se determinó en consecuencia. Estos experimentos se realizaron utilizando células HEK293. Los resultados se representaron como media ± DE (n =3 experimentos independientes, ** P <0,01, *** P <0,001). Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0037-y.
Los hallazgos mostraron que el método de trituración de células a microescala propuesto era más eficiente que los kits comerciales al producir aproximadamente un 40 por ciento más de mitocondrias funcionales. Los científicos pudieron preservar la integridad estructural de los orgánulos extraídos incluso a bajas concentraciones de células. El método podría procesar rápidamente una cantidad limitada de muestras (200 µl).
Los resultados detallados fueron la primera demostración en un estudio de extracción de mitocondrias intactas y funcionales utilizando estrés hidrodinámico a microescala. La posibilidad de procesar una concentración baja y un tamaño de muestra pequeño es favorable para las investigaciones clínicas de la enfermedad mitocondrial. Para probar la tensión ejercida por la unión transversal diseñada, primero utilizaron un modelo de simulación multifísica COMSOL. Después de eso, Rahman y col. determinó experimentalmente la tasa de flujo volumétrico para tres líneas celulares modelo. Durante la alteración experimental de la membrana celular, bajo esfuerzo cortante medio (16,4 Pa, para un caudal de 60 µL / min), se liberaron orgánulos subcelulares y se detectaron con un aumento de las señales positivas mitocondriales.
Los científicos compararon la capacidad de la trituradora de células miniaturizada con la de dos kits comerciales:el homogeneizador Dounce (método mecánico de alteración celular) y el kit de aislamiento de mitocondrias Qproteome (método químico de alteración celular) para extraer mitocondrias. Para determinar el número de mitocondrias funcionales extraídas, los científicos utilizaron MitoTracker, un tinte fluorescente que tiñe las mitocondrias durante el análisis de citometría de flujo. Los resultados mostraron que la trituradora de células a microescala fue capaz de extraer un 40 por ciento más de mitocondrias funcionales en comparación con los kits comerciales para células HEK 293 y C2C12.
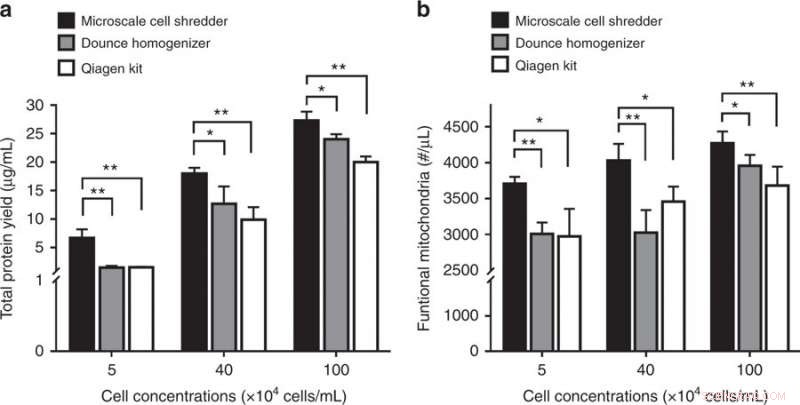
Alteración de las células del neuroblastoma (SH-SY5Y) y posterior extracción mitocondrial. a Rendimiento total de proteínas yb concentraciones de mitocondrias funcionales obtenidas de los tres métodos de extracción. Los resultados se representaron como media ± DE (n =3 experimentos independientes, * P <0,05, ** P <0,01). Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0037-y.
Rahman y col. realizó el ensayo de citrato sintasa para determinar la integridad mitocondrial a través de la actividad enzimática de las mitocondrias dañadas. Como antes, en comparación con los kits comerciales, La integridad mitocondrial fue mayor para los extraídos con la trituradora de microescala en células HEK293 y C2C12.
El estudio demostró la importancia de la rigidez de la membrana al validar el concepto propuesto para alterar las membranas celulares del neuroblastoma (SH-SY5Y). Dado que la membrana celular SH-SY5Y tenía un módulo elástico más alto que las líneas celulares HEK293 y C2C12, los científicos tuvieron que optimizar la tasa de flujo volumétrico en la trituradora de microescala para interrumpir eficazmente las membranas celulares SH-SY5Y. De nuevo, en comparación con las extracciones de kits comerciales, El uso del método propuesto proporcionó una concentración significativamente mayor de proteínas y mitocondrias funcionales para la línea celular de interés.

Se incluye una sección de cuello en el diseño del canal de la trituradora de células a microescala para asegurar que las células estén enfocadas lateralmente al centro de la corriente de flujo en el biorreactor de microfluidos. Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0037-y
De este modo, Rahman y col. investigó la posibilidad de alterar la membrana celular para retener la integridad de las membranas mitocondriales en diversas líneas celulares modelo de mamíferos. Determinaron la tensión extensional óptima y la tasa de flujo dentro de un biorreactor de sección transversal de microfluidos, basado en el módulo de Young de la línea celular modelo de interés. Durante el diseño del canal, los científicos incluyeron una sección de estrechamiento en el biorreactor de microfluidos fabricado mediante litografía blanda.
La trituradora de microescala de microfluidos propuesta demostró una capacidad superior para extraer mitocondrias y proteínas funcionales mediante el control del estrés hidrodinámico por primera vez. en comparación con los kits de extracción de orgánulos celulares disponibles comercialmente. Los experimentos fueron factibles incluso con cantidades mínimas de muestras (volumen de 200 µl, que contiene 10 4 células / ml) para posibles aplicaciones clínicas. Rahman y col. pudieron replicar fielmente el protocolo en tres líneas celulares. El trabajo experimental puede trasladarse a un entorno clínico para comprender en profundidad los trastornos relacionados con la disfunción mitocondrial.
© 2019 Science X Network