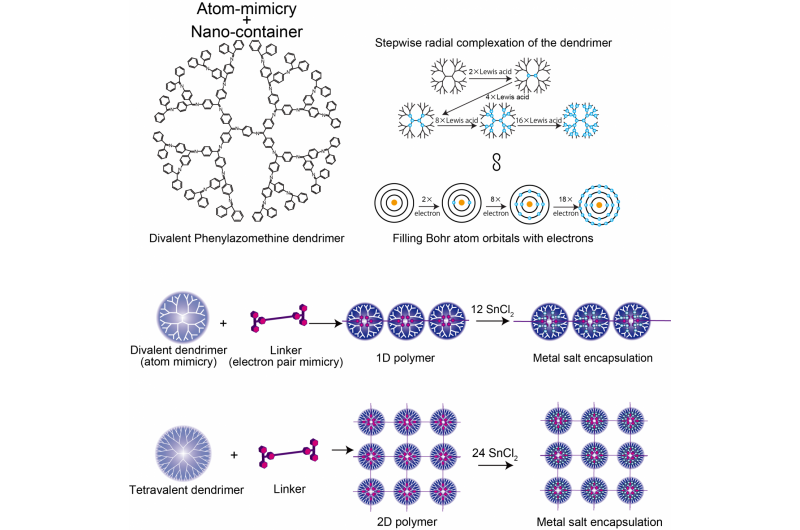
La estructura del dendrímero de fenilazomentina divalente, Comparación del modelo de átomo de DPA y Bohr, y polímero supramolecular 1D / 2D. Crédito:Instituto de Tecnología de Tokio
En nanotecnología el control es clave. El control sobre las disposiciones y las distancias entre las nanopartículas puede permitir fuerzas de interacción personalizadas para que las propiedades se puedan aprovechar en dispositivos como los sensores plasmónicos. Ahora, los investigadores del Instituto de Tecnología de Tokio utilizan dendrímeros que imitan la valencia electrónica de los átomos y los enlazan en matrices utilizando moléculas que se coordinan con el dendrímero, ya que formarían un par de electrones covalentes en su capa de valencia:"imitación de pares de electrones".
Kimihisa Yamamoto, Ken Albrecht, y sus colegas de Tokyo Tech consideraron la polifenilazometina dendrítica (DPA), que tiene una estructura que se ramifica a partir de un núcleo central. Las moléculas de "ácido de Lewis" se coordinan con los sitios de "base de Lewis" del DPA. El análisis de la proporción de moléculas de ácido de Lewis SnCl2 coordinadas con cada dendrímero reveló incrementos en el paso de 2 a 4 a 8 a 16, que imita la valencia del átomo de Bohr que tiene 2, 8, 18, y 32 electrones en el primero, 2do, Tercero, y 4º orbitales. Esto refleja el aumento en el número de moléculas que pueden coordinarse con el dendrímero al aumentar la distancia desde el núcleo, a medida que aumenta el número de ramificaciones de dendrímero y la densidad de electrones.
El equipo de Yamamoto analizó la coordinación de DPA con un ácido de Lewis de unión más fuerte, el trifenilmetilio (TPM), unido a la molécula de fenileno etinileno en forma de varilla. La cadena principal de etilenetileno es lo suficientemente rígida como para que los cationes ácidos en cada extremo no puedan unirse al mismo dendrímero. En cambio, se forma una cadena polimérica de dendrímeros. El uso de un dendrímero de partida diferente (ZnPG4 en lugar de DPAG4), que tiene una valencia central de cuatro en lugar de dos, condujo a la formación de polimerización bidimensional de los dendrímeros, produciendo una matriz 2D de nanocontenedores para que puedan acumular otros ácidos de Lewis en los orbitales externos.
El trabajo describe "un nuevo aspecto del mimetismo de átomos", concluyen los investigadores. "La geometría y el tono se pueden controlar mediante el diseño del dendrímero y el enlazador y son potencialmente aplicables a plasmónicos (después del crecimiento mediado por semillas) y rejillas de nanoelectrodos (que también son útiles como electrocatalizadores)".
El estudio se publica en Avances de la ciencia .
Átomo de Bohr
El modelo de Bohr del átomo establecido por Niels Bohr y Ernest Rutherford en 1913 describe el átomo como un núcleo positivo rodeado de electrones en diferentes capas o niveles de energía. Cada capa tiene un número prescrito de electrones que pueden ocuparla, es decir, dos electrones pueden ocupar la primera capa, ocho el siguiente, y dieciocho el siguiente, etcétera.
Si bien hay aspectos del comportamiento del átomo que el modelo no cubre, es particularmente exitoso para explicar las líneas de emisión espectral. Cuando está emocionado, un electrón puede saltar al siguiente nivel de energía. Cuando vuelve al nivel de energía inicial, la diferencia de energías se emite como luz en la longitud de onda específica equivalente a la diferencia de energía.
Donde un caparazón no está lleno, el átomo puede unirse con otra especie química. De esta manera, la valencia de un átomo describe cuán llena está la capa de electrones y cuán fácilmente se pueden formar enlaces. El gradiente de densidad de electrones de los dendrímeros que se mueven radialmente desde el núcleo a las regiones externas más ramificadas dicta cuántas moléculas coordinadoras de ácido de Lewis puede acomodar y de esta manera imita los niveles de energía del átomo de Bohr.
¿Qué es un ácido de Lewis?
Un ácido de Lewis es una especie química que puede aceptar un par de electrones de una sustancia química que puede donar un par solitario, es decir, desde una base de Lewis. Este comportamiento está definido por la estructura electrónica de la sustancia química. Los ácidos de Lewis incluyen compuestos ácidos pero también cationes metálicos.
Cuando el dendrímero se coordina con los ácidos de Lewis, ocupa el lugar de la base de Lewis que donaría un par de electrones. Los investigadores describen el compuesto ácido di-Lewis (molécula enlazadora) como un mimetismo de pares de electrones.
Puntos isosbésticos
Cuando dos sustancias químicas reaccionan, la cantidad de luz absorbida puede cambiar dependiendo de la cantidad de luz que absorban los productos frente a los reactivos. Si los productos y reactivos absorben la misma cantidad de luz a una longitud de onda particular, se describe como el punto isosbéstico.
Los investigadores utilizaron puntos isosbésticos para identificar los incrementos escalonados en el ácido de Lewis que reacciona con los dendrímeros. Un cambio de longitud de onda en el punto isosbéstico indica la coordinación del ácido de Lewis con la capa subsiguiente del dendrímero.