
El agua es diferente a otras sustancias porque su forma sólida, como este iceberg, es menos densa que su forma líquida, como este océano. Los científicos están estudiando otras extrañas propiedades del agua. Crédito:Wikimedia Commons
El agua tiene muchas propiedades inusuales, como su forma sólida, hielo, poder flotar en agua líquida, y se vuelven más raros por debajo de su punto de congelación. El agua sobreenfriada, por debajo del punto de congelación pero aún líquida, es notoriamente difícil de estudiar. Algunos investigadores pensaron que el agua superenfriada se comportaba de manera extraña dentro de un rango particularmente frío, pasando de un líquido a un sólido, cristalizando instantáneamente a una temperatura particular como algo sacado de una novela de Kurt Vonnegut.
Ahora, Los investigadores han descubierto una manera de tomar instantáneas del agua que se congela dentro de ese rango profundamente sobreenfriado. ¿Y adivina qué? El agua no es tan rara como podría ser. El agua líquida puede existir hasta el final, cristalizando en un sólido más lentamente a medida que las cosas se enfrían, como se esperaba, pero nunca todos a la vez.
Un equipo de investigadores del Laboratorio Nacional del Noroeste del Pacífico del Departamento de Energía informó el trabajo en la publicación de esta semana. procedimientos de la Academia Nacional de Ciencias Early Edition en línea. Aunque los resultados no cambiarán la forma en que prepara su té helado en el verano, podría ayudar a los teóricos a desarrollar su comprensión del agua y ayudar a los científicos atmosféricos a comprender mejor la lluvia y las nubes.
Un truco de agua extraño
La mayoría de la gente sabe que el hielo flota sobre agua líquida, pero es posible que no se den cuenta de que el agua tiene dificultades para formar un vaso. Un vidrio, como una ventana, es un sólido en el que las moléculas están dispuestas como si estuvieran en un líquido.
Toma un manojo de naranjas. Las naranjas mezcladas libremente en una bolsa son como un líquido:las moléculas individuales pueden moverse con bastante libertad. Si empaca las naranjas ordenadamente en una caja, formas un cristal. Si aprieta la bolsa y evita que las naranjas revueltas se muevan pero sin organizarlas ordenadamente, formas un vaso.
Los anteojos son excelentes porque pueden contener contaminantes; piense en una mosca en ámbar, o desechos nucleares en vidrio vitrificado, mientras que los cristales eliminan los contaminantes, congelar el agua de mar es una forma de desalinizarla. Para hacer un vaso los investigadores derriten arena u otro componente hasta que se vuelva líquido. Y luego lo enfrían tan rápido que no puede formar un cristal antes de solidificarse.
Pero congele el agua a granel rápidamente y no forma un vaso. Rápidamente se convierte en hielo. Convertirse en vidrio el agua líquida debe enfriarse a una temperatura profundamente bajo cero en microsegundos, aproximadamente 136 Kelvin (aproximadamente menos 215 grados F), una temperatura común en el espacio exterior, donde algunos esperan que exista agua cristalina.
El intervalo que ha sido difícil de estudiar está ligeramente por encima de la denominada temperatura de transición vítrea. Los científicos no saben qué está pasando entre 160 y 235 K. (En la vida real, eso está entre la temperatura en la luna de Marte, Fobos y Fairbanks, Alaska, en la profundidad del invierno.) En el extremo superior de ese rango (más cerca de 235 K, Fairbanks), el agua se congela de un líquido sobreenfriado a un cristal en milisegundos, que es demasiado rápido para estudiar las técnicas analíticas actuales.
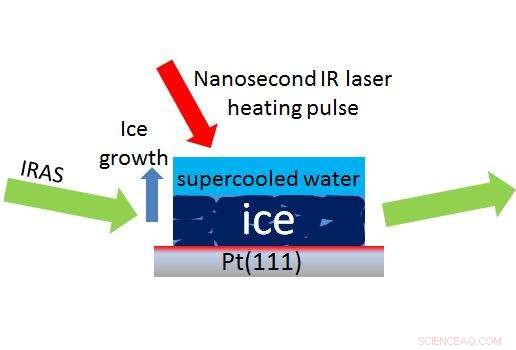
Un láser (flecha roja) crea una pequeña gota de agua sobreenfriada sobre el hielo, permitiendo a los científicos usar un método llamado IRAS (flechas verdes) para medir en nanosegundos qué tan rápido el agua sobreenfriada se convierte de nuevo en hielo. Crédito:Kay, Kimmel / PNNL
A los científicos se les ocurrió una variedad de ideas para explicar lo que podría estar sucediendo en esa región inexplorada. Se preguntaban si el agua seguiría siendo metaestable, líquida pero preparada para comenzar a cristalizar en cualquier momento, hasta alcanzar temperaturas en las que se convierta en un vaso. O si el líquido se volviera inestable en algún lugar más cálido que eso, alrededor de 228 K (un poco más cálido que los mínimos históricos en la estación McMurdo en la Antártida), en cuyo punto cristalizaría espontáneamente debido a lo que los físicos llaman una singularidad. También, Es posible que esté sucediendo algo dentro de ese rango que pueda ayudar a explicar por qué el agua tiene dificultades para formar un vaso.
"Había una plétora de postulados pero escasez de datos, "dijo el físico químico de PNNL Bruce Kay.
"Nuestro objetivo era desarrollar una nueva técnica para calentar y enfriar rápidamente películas de agua superenfriadas a nanoescala, "dijo el físico de PNNL Greg Kimmel.
El misterio interior
Para obtener los datos en ese rango inconmensurable, Kimmel y Kay trabajaron con Yuntao Xu, un experto en láser, y otros en PNNL y desarrollaron una forma de calentar y enfriar agua en escalas de tiempo de nanosegundos con un láser. Usando este método, Los científicos del PNNL midieron la rapidez con la que el agua superenfriada se convertía en hielo cristalino a medida que bajaba la temperatura. El tiempo de cristalización se redujo de nanosegundos cerca de las temperaturas más altas a horas a 126 K. En ningún momento, especialmente a 228 K, ¿El agua sobreenfriada se rompió en un cristal? descartando la posibilidad de una singularidad.
Para buscar la singularidad desde otro ángulo, los investigadores exploraron qué tan rápido se podían mover las moléculas de agua sobreenfriada, y cuánto cambió a medida que hacía más frío. Si existiera la singularidad, esperarían que las moléculas de agua no pudieran moverse en algún momento. Desde el punto de congelación hasta el punto de cristalización, las moléculas se movían cada vez más lentamente de una manera compleja pero continua. En general, la relación entre la temperatura y la rapidez con que se mueven las moléculas no sugiere una singularidad a 228 K.
"Probablemente podamos quitar la singularidad de la mesa, "dijo Kay de PNNL.
Tomados en conjunto, los resultados proporcionan información valiosa sobre cómo se comporta el agua.
"Por ejemplo, en química atmosférica, Las gotas de agua sobreenfriadas se encuentran en las nubes. Hay preguntas sobre cuánto tiempo persisten, "dijo Kimmel de PNNL.