Las moléculas de agua unidas más cercanas al mineral tienen un rígido, estructura similar al hielo y no puede moverse en arreglos que permitan reacciones químicas. Las moléculas de agua más alejadas de la superficie del mineral tienen un estructura líquida y puede organizarse para promover la reactividad. Crédito:Laboratorio de Ciencias Moleculares Ambientales
Un equipo de investigadores dirigido por el científico computacional de PNNL Simone Raugei ha revelado nuevos conocimientos sobre cómo esta compleja enzima hace su trabajo. encontrar que la formación aparentemente derrochadora de hidrógeno tiene un propósito esencial. Su papel "El análisis computacional crítico ilumina el mecanismo de eliminación reductora que activa la nitrogenasa para N 2 reducción, "fue publicado en el procedimientos de la Academia Nacional de Ciencias en noviembre de 2018. Los coautores de Raugei son Lance Seefeldt, quien tiene un cargo conjunto en PNNL y la Universidad Estatal de Utah, y Brian Hoffman de la Universidad Northwestern.
La nitrogenasa puede convertir nitrógeno en amoníaco a temperatura ambiente y presión atmosférica. Industria, por otra parte, se basa en el proceso Haber-Bosch, una técnica centenaria que utiliza alta temperatura y presión. Los combustibles fósiles suelen proporcionar la energía para este proceso, razón por la cual la producción industrial de amoníaco por sí sola representa más del 1% de las emisiones totales de carbono relacionadas con la energía en el mundo. Comprender qué es lo que le da a la nitrogenasa su músculo de ruptura de enlaces puede conducir a nuevos, ideas estimulantes para el diseño de catalizadores sintéticos para la fabricación de amoníaco.
Por cada molécula de nitrógeno transformada en amoníaco, nitrogenasa produce al menos una molécula de hidrógeno (H 2 ), que es "uno de los misterios más desconcertantes de la nitrogenasa, "Dijo Raugei." En lugar de simplemente producir amoníaco, también produce este subproducto. ¿Por qué es eso necesario? "
Los investigadores encontraron que este fenómeno en realidad ayuda a la nitrogenasa a combatir los fuertes enlaces del nitrógeno. "La naturaleza encontró una solución al acoplar la producción de hidrógeno, que libera energía, con nitrógeno escindido, que requiere energía, "Dijo Raugei." Es un equilibrio total ".
Para llegar a los resultados, el equipo utilizó una combinación de métodos teóricos y experimentales. Raugei realizó cálculos químicos cuánticos en modelos del núcleo de la enzima, confiando en la guía de Seefeldt y Hoffman, que son expertos en la bioquímica de la nitrogenasa. Sus datos experimentales ayudaron a informar los cálculos, y viceversa.
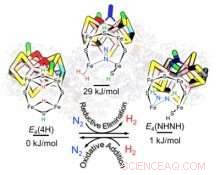
Los investigadores se centraron en el núcleo catalítico de nitrogenasa, compuesto de hierro, molibdeno y azufre (FeMo-co). Durante el evento catalítico, cuando FeMo-co ha adquirido un número crítico de electrones y protones (H +) en forma de dos hidruros puente (Fe-H-Fe) en su cinturón periférico, generación de una H 2 unido a FeMo-co y su desplazamiento por N 2 proporciona el toma y daca de energía para provocar la reducción de nitrógeno, los investigadores encontraron.
"Estábamos muy bien posicionados para lograr este gran avance porque combinamos la información experimental sobre la nitrogenasa con la información computacional, "Dijo Raugei." Esa fue la clave ".
Los investigadores buscan extender la investigación examinando los detalles finos de la acumulación de electrones y protones en el sitio activo de la nitrogenasa y exactamente cómo el N 2 el enlace se rompe para formar amoniaco.